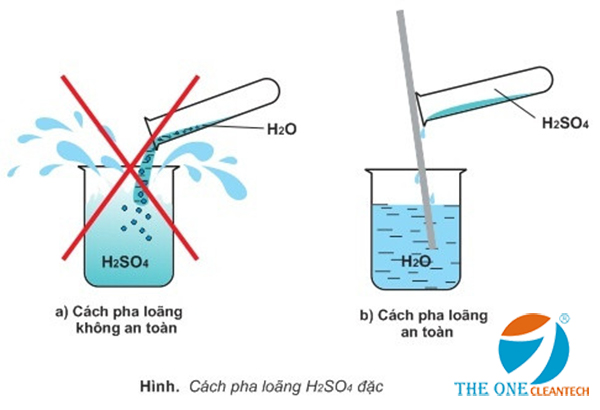
Tính chất hóa học của H2SO4
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Axit sunfuric (H2SO4) là một axit mạnh có nhiều tính chất hóa học đặc trưng. Bạn sẽ tìm thấy trong bài viết này thông tin chi tiết về các phản ứng hóa học quan trọng của H2SO4, bao gồm cả tính axit mạnh và tính oxi hóa mạnh của nó.
Tính axit mạnh của H2SO4
Phản ứng với kim loại
H2SO4 loãng phản ứng với nhiều kim loại đứng trước H trong dãy hoạt động hóa học tạo thành muối sunfat và giải phóng khí hiđro: Fe + H2SO4 → FeSO4 + H2. Tuy nhiên, với H2SO4 đặc nóng, phản ứng phức tạp hơn và thường tạo ra muối sunfat, nước và sản phẩm khử của lưu huỳnh (SO2, S, H2S) tùy thuộc vào nồng độ axit và bản chất của kim loại.Phản ứng với oxit bazơ
H2SO4 phản ứng với oxit bazơ tạo thành muối sunfat và nước: CuO + H2SO4 → CuSO4 + H2O.Phản ứng với bazơ
H2SO4 phản ứng với bazơ tạo thành muối sunfat và nước: 2NaOH + H2SO4 → Na2SO4 + 2H2O. Đây là phản ứng trung hòa.Phản ứng với muối
H2SO4 có thể phản ứng với một số muối tạo thành muối mới và axit mới (nếu axit mới yếu hơn H2SO4): BaCl2 + H2SO4 → BaSO4↓ + 2HCl. Phản ứng này tạo kết tủa trắng BaSO4.Tính oxi hóa mạnh của H2SO4 đặc, nóng
H2SO4 đặc nóng thể hiện tính oxi hóa mạnh, tác dụng được với nhiều chất, đặc biệt là các kim loại đứng sau H trong dãy hoạt động hóa học và một số phi kim. Sản phẩm khử của lưu huỳnh có thể là SO2, S hoặc H2S tùy thuộc vào điều kiện phản ứng.Phản ứng với kim loại
Cu + 2H2SO4(đặc) → CuSO4 + SO2 + 2H2OPhản ứng với phi kim
C + 2H2SO4(đặc) → CO2 + 2SO2 + 2H2OPhản ứng với các chất khử khác
H2SO4 đặc nóng có thể oxi hóa nhiều chất khử khác, ví dụ như H2S, KI, ... tạo ra các sản phẩm khử khác nhau của lưu huỳnh và các sản phẩm oxi hóa của chất khử. Bài viết này chỉ tóm tắt một số tính chất hóa học quan trọng của H2SO4. Để hiểu sâu hơn, bạn cần tìm hiểu thêm trong các tài liệu hóa học chuyên sâu hơn.Sản phẩm liên quan: cung hoc tieng anh
Xem thêm: cá diêu hồng kho thơm
Xem thêm: từ trường tiếng anh