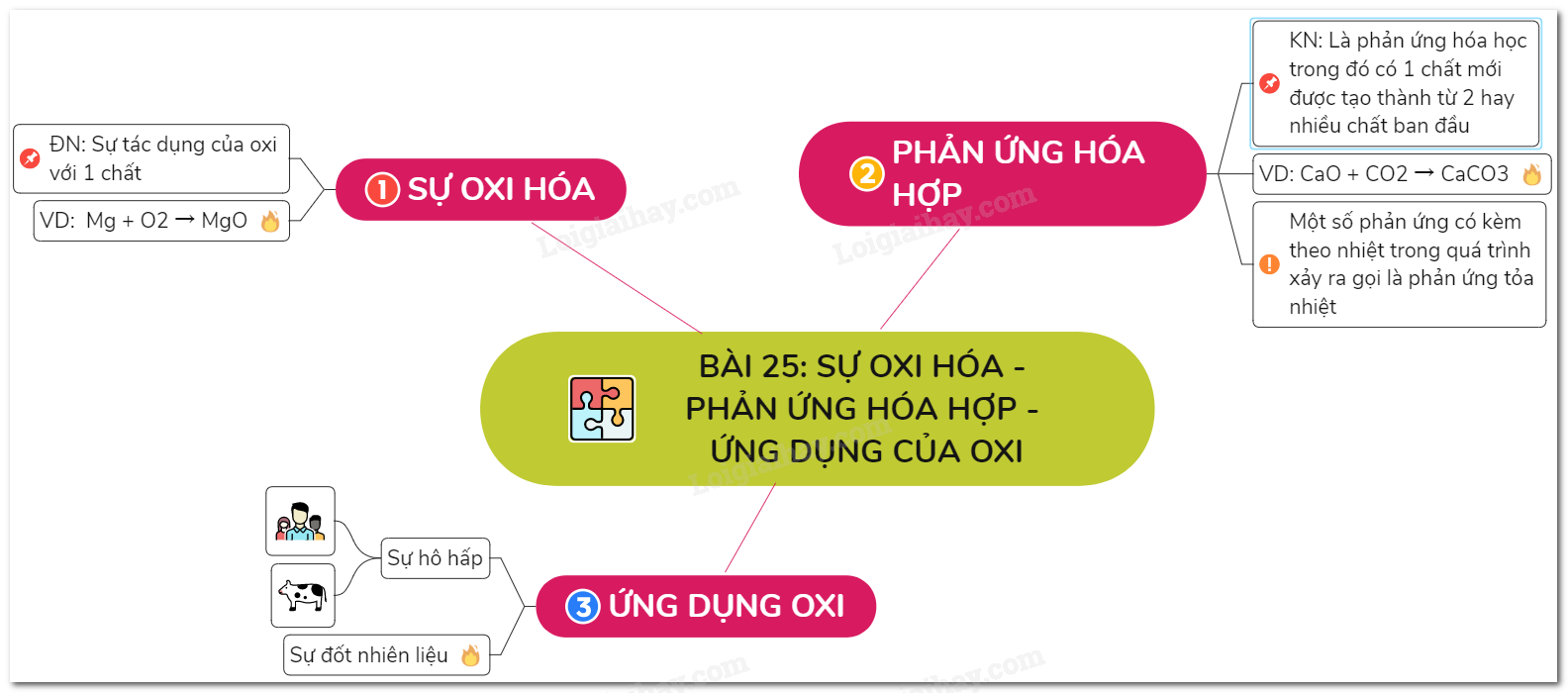
Phản ứng hóa hợp lớp 8
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng hóa hợp lớp 8 là phản ứng hóa học mà từ hai hay nhiều chất tham gia phản ứng, chỉ tạo ra duy nhất một chất sản phẩm.
Định nghĩa phản ứng hóa hợp
Đặc điểm chính của phản ứng hóa hợp:
Từ hai hay nhiều chất tham gia phản ứng tạo thành một chất sản phẩm duy nhất. Ví dụ: phản ứng giữa hai nguyên tố tạo thành một hợp chất.Ví dụ về phản ứng hóa hợp
Một số phản ứng hóa hợp thường gặp:
- Phản ứng giữa kim loại và phi kim: 2Mg + O2 → 2MgO
- Phản ứng giữa phi kim và phi kim: S + O2 → SO2
- Phản ứng giữa oxit bazơ và nước: CaO + H2O → Ca(OH)2
- Phản ứng giữa oxit axit và nước: SO3 + H2O → H2SO4
Cách cân bằng phản ứng hóa hợp
Cân bằng phương trình phản ứng hóa hợp:
Việc cân bằng phương trình phản ứng hóa hợp tuân theo định luật bảo toàn khối lượng. Để cân bằng, bạn cần điều chỉnh hệ số trước các chất tham gia và sản phẩm sao cho số nguyên tử của mỗi nguyên tố ở hai vế của phương trình bằng nhau. Ví dụ, để cân bằng phương trình 2Mg + O2 → 2MgO, ta thấy số nguyên tử Mg và O ở hai vế đều bằng nhau.Sản phẩm liên quan: de thi tiếng anh lớp 2 giữa học kì 1
Sản phẩm liên quan: than hoạt tính tiếng anh
Sản phẩm hữu ích: ancol no đa chức
Sản phẩm hữu ích: txđ hàm số mũ