Phản ứng hóa học là gì?


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng hóa học là quá trình biến đổi chất này thành chất khác. Trong quá trình này, các chất tham gia phản ứng (chất phản ứng) sẽ bị biến đổi thành các chất mới (sản phẩm) với các tính chất khác nhau.
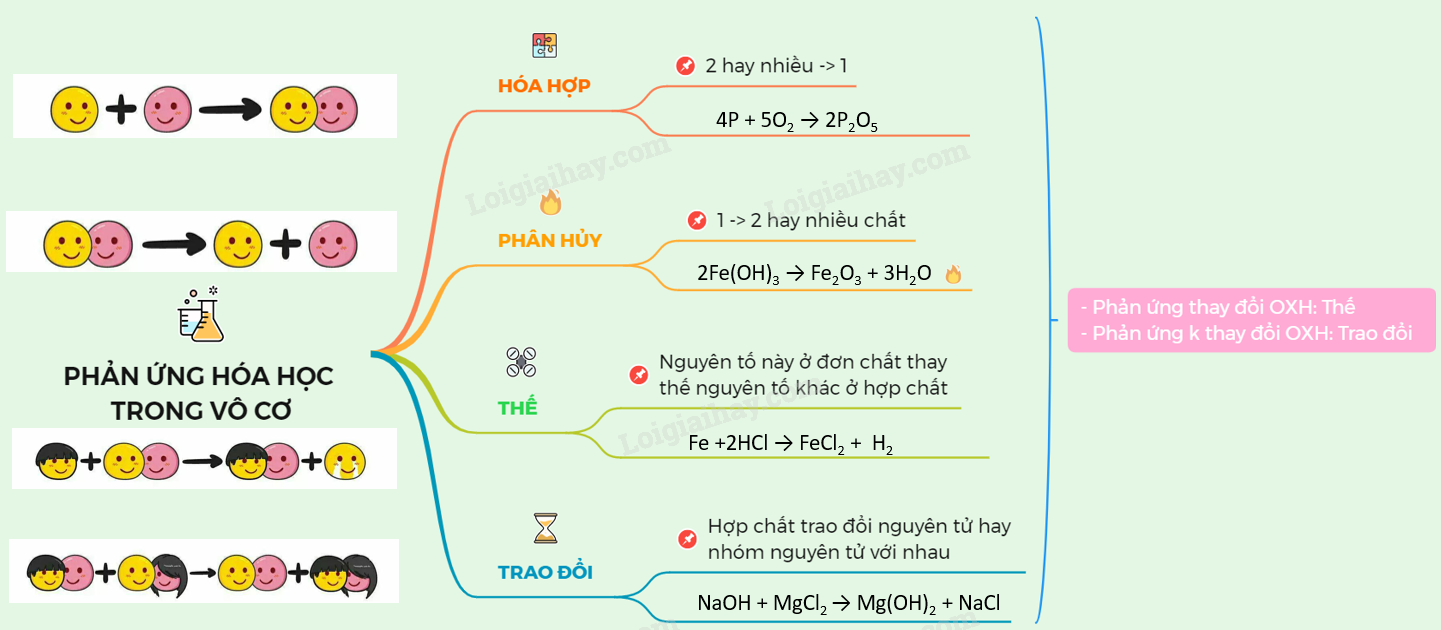
Các loại phản ứng hóa học
Phản ứng hóa hợp:
Là phản ứng hóa học trong đó hai hay nhiều chất tham gia phản ứng kết hợp với nhau tạo thành một chất sản phẩm duy nhất. Ví dụ: 2H₂ + O₂ → 2H₂O (Khí hiđro tác dụng với khí oxi tạo thành nước).Phản ứng phân hủy:
Là phản ứng hóa học trong đó một chất tham gia phản ứng bị phân hủy thành hai hay nhiều chất sản phẩm. Ví dụ: 2KClO₃ → 2KCl + 3O₂ (Kali clorat bị phân hủy thành kali clorua và khí oxi).Phản ứng thế:
Là phản ứng hóa học trong đó nguyên tử của một đơn chất thay thế nguyên tử của một nguyên tố khác trong hợp chất. Ví dụ: Zn + 2HCl → ZnCl₂ + H₂ (Kẽm tác dụng với axit clohiđric tạo thành kẽm clorua và khí hiđro).Phản ứng trao đổi:
Là phản ứng hóa học trong đó hai hợp chất tham gia phản ứng trao đổi với nhau các thành phần cấu tạo để tạo thành hai hợp chất mới. Ví dụ: AgNO₃ + NaCl → AgCl + NaNO₃ (Bạc nitrat tác dụng với natri clorua tạo thành bạc clorua và natri nitrat).Yếu tố ảnh hưởng đến tốc độ phản ứng
Nhiều yếu tố ảnh hưởng đến tốc độ của phản ứng hóa học, bao gồm: nồng độ chất phản ứng, nhiệt độ, áp suất (đối với phản ứng khí), diện tích bề mặt tiếp xúc (đối với phản ứng chất rắn), chất xúc tác. Tăng nồng độ chất phản ứng, nhiệt độ, áp suất (đối với phản ứng khí), diện tích bề mặt tiếp xúc thường làm tăng tốc độ phản ứng. Chất xúc tác là chất làm tăng tốc độ phản ứng mà không bị biến đổi trong quá trình phản ứng.Ứng dụng của phản ứng hóa học
Phản ứng hóa học có ứng dụng rộng rãi trong đời sống và sản xuất, từ việc sản xuất phân bón, thuốc, vật liệu xây dựng cho đến việc chế biến thực phẩm, bảo vệ môi trường… Việc hiểu biết về phản ứng hóa học là rất cần thiết để giải quyết nhiều vấn đề trong các lĩnh vực khác nhau.Sản phẩm hữu ích: tính công suất động cơ
Xem thêm: chim mới nở ăn gì
Sản phẩm liên quan: tập xác định của e mũ x