Mức Năng Lượng Electron
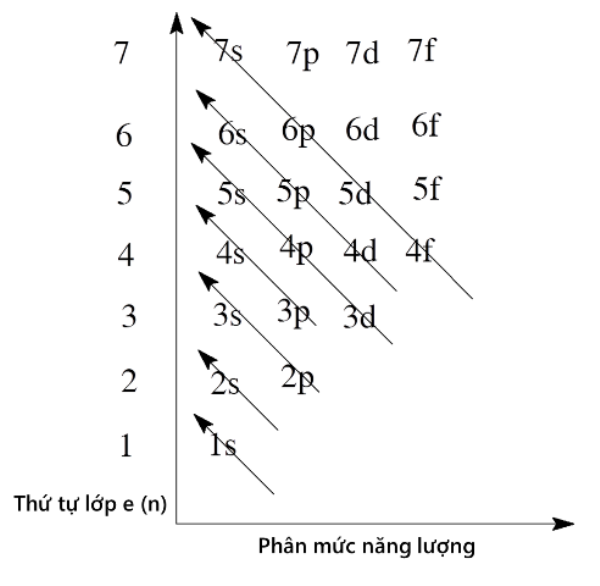
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Mức năng lượng electron là lượng năng lượng mà một electron sở hữu khi nằm trong một nguyên tử hoặc phân tử. Năng lượng này không thể có giá trị tùy ý mà chỉ tồn tại ở những giá trị riêng biệt, được gọi là mức năng lượng. Các mức năng lượng này được xác định bởi cấu hình electron và tương tác điện từ với hạt nhân và các electron khác.
Mô hình nguyên tử Bohr và mức năng lượng
Nguyên lý lượng tử hóa năng lượng
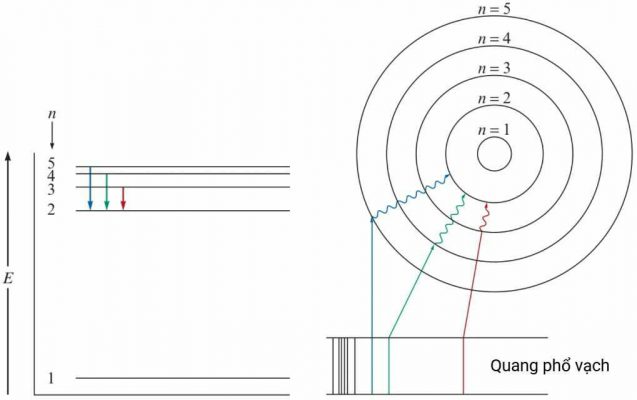
Mô hình nguyên tử Bohr đơn giản hóa vấn đề bằng cách mô tả electron chuyển động quanh hạt nhân trên các quỹ đạo xác định. Mỗi quỹ đạo tương ứng với một mức năng lượng cụ thể. Electron chỉ có thể tồn tại ở các mức năng lượng này và không thể nằm giữa chúng. Khi electron chuyển từ mức năng lượng thấp lên mức năng lượng cao, nó hấp thụ một lượng năng lượng bằng đúng hiệu số năng lượng giữa hai mức. Ngược lại, khi chuyển từ mức năng lượng cao xuống mức năng lượng thấp, nó sẽ giải phóng năng lượng dưới dạng photon. Đây là cơ sở của quang phổ nguyên tử.
Công thức tính năng lượng
Năng lượng của electron trong nguyên tử hydro (mô hình Bohr) được tính bằng công thức:
En = -13.6/n² eV
trong đó n là số lượng tử chính (n = 1, 2, 3,...), En là năng lượng của electron ở mức năng lượng n (eV).
Mức năng lượng trong nguyên tử đa electron
Ảnh hưởng của tương tác electron-electron
Trong nguyên tử đa electron, tương tác giữa các electron làm cho việc tính toán mức năng lượng trở nên phức tạp hơn nhiều so với mô hình Bohr. Các electron tương tác với nhau thông qua lực đẩy tĩnh điện, ảnh hưởng đến năng lượng của từng electron. Để mô tả chính xác mức năng lượng trong nguyên tử đa electron, người ta phải sử dụng các phương pháp lượng tử phức tạp hơn, ví dụ như phương pháp Hartree-Fock hoặc lý thuyết chức năng mật độ.
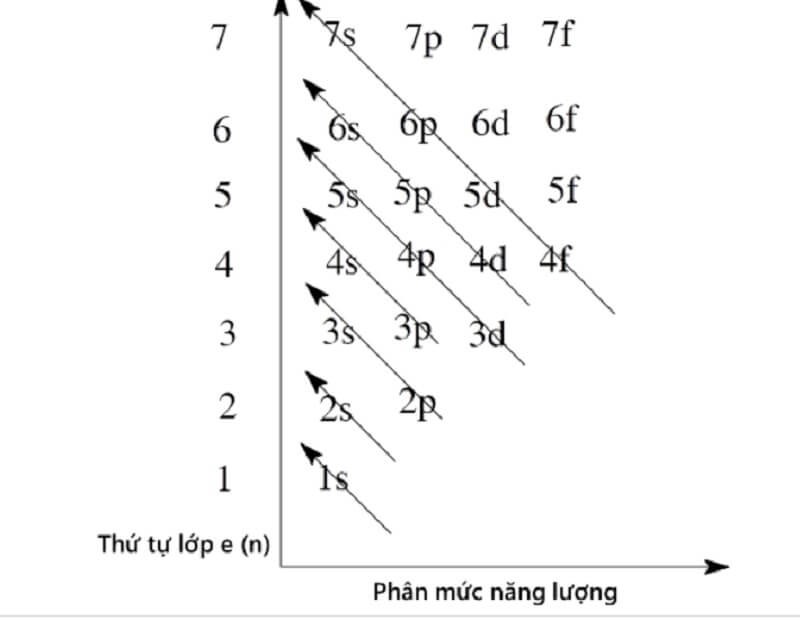
Số lượng tử và mức năng lượng
Ngoài số lượng tử chính (n), còn có các số lượng tử khác như số lượng tử azimuthal (l), số lượng tử từ (ml) và số lượng tử spin (ms) xác định trạng thái lượng tử của electron và do đó ảnh hưởng đến mức năng lượng của nó. Mỗi tổ hợp các số lượng tử này tương ứng với một obitan nguyên tử, và mỗi obitan có thể chứa tối đa hai electron với spin ngược nhau (nguyên lý Pauli).
Ứng dụng của mức năng lượng electron
Hiểu về mức năng lượng electron rất quan trọng trong nhiều lĩnh vực, bao gồm:
- Hóa học lượng tử: Dự đoán tính chất hóa học của phân tử.
- Vật lý nguyên tử: Giải thích quang phổ nguyên tử và phân tử.
- Vật lý bán dẫn: Thiết kế và phát triển các thiết bị bán dẫn.
- Công nghệ laser: Hiểu và tạo ra bức xạ laser.
Sản phẩm liên quan: sodium carbonate and sulfuric acid
Xem thêm: harvard business review là gì
Sản phẩm liên quan: công thức cấu tạo của saccarozo
Sản phẩm liên quan: bài 2 khái quát về tư tưởng hồ chí minh