Lớp Electron Ngoài Cùng
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Lớp electron ngoài cùng là lớp electron có mức năng lượng cao nhất trong nguyên tử, quyết định tính chất hóa học của nguyên tố. Những electron này tham gia vào việc hình thành liên kết hóa học với các nguyên tử khác.
Vai trò của lớp electron ngoài cùng
Ảnh hưởng đến tính chất hóa học
Nguyên tố có cùng số electron lớp ngoài cùng thường có tính chất hóa học tương tự nhau. Ví dụ, các nguyên tố nhóm halogen (như flo, clo, brom) đều có 7 electron ở lớp ngoài cùng và đều có tính oxi hóa mạnh. Số lượng electron ở lớp ngoài cùng quyết định khả năng tạo liên kết hóa học, tính chất oxi hóa hoặc khử của nguyên tố.Sự hình thành liên kết hóa học
Electron ở lớp ngoài cùng tham gia vào việc hình thành liên kết ion, liên kết cộng hóa trị và liên kết kim loại. Trong liên kết ion, nguyên tử mất hoặc nhận electron để đạt cấu hình electron bền vững của khí hiếm. Trong liên kết cộng hóa trị, các nguyên tử chia sẻ electron ở lớp ngoài cùng. Trong liên kết kim loại, electron lớp ngoài cùng di chuyển tự do giữa các nguyên tử kim loại.Cấu hình electron và lớp electron ngoài cùng
Xác định lớp electron ngoài cùng
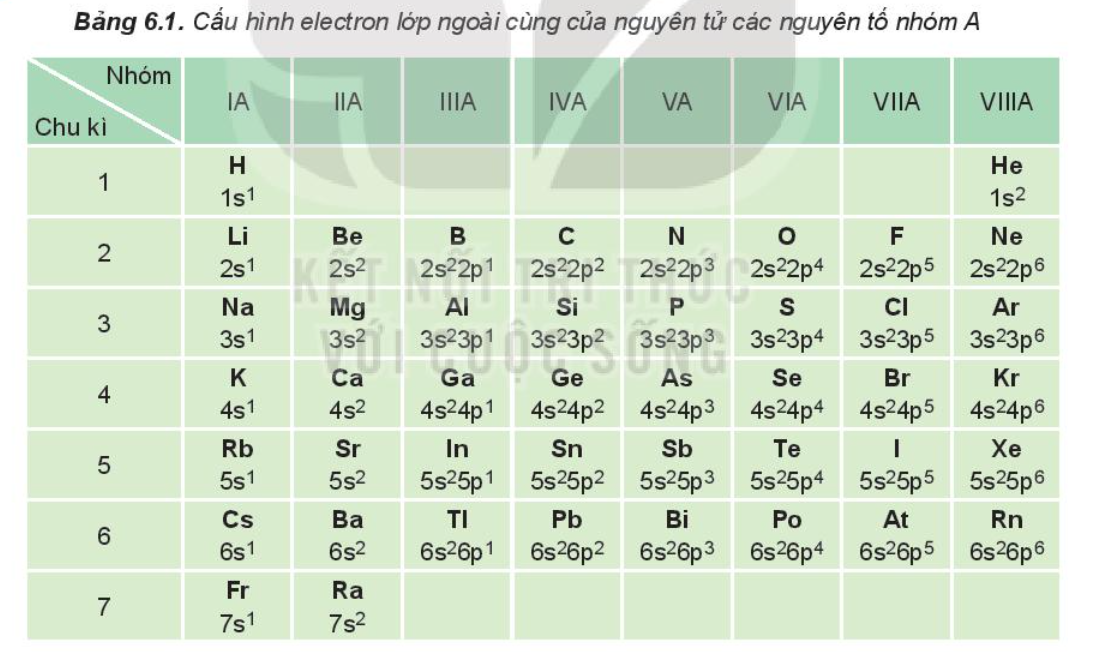
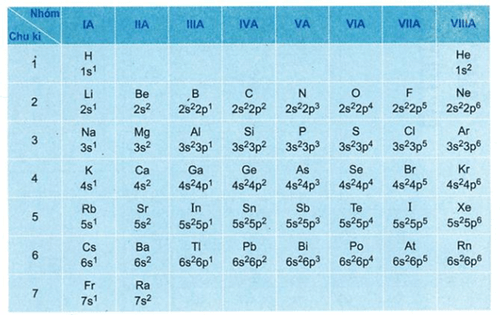
Để xác định lớp electron ngoài cùng của một nguyên tố, ta cần biết cấu hình electron của nguyên tố đó. Cấu hình electron cho biết sự phân bố electron trong các lớp và phân lớp năng lượng. Lớp electron ngoài cùng là lớp có mức năng lượng cao nhất trong cấu hình electron. Ví dụ, nguyên tử natri (Na) có cấu hình electron là 1s22s22p63s1, lớp electron ngoài cùng là lớp thứ 3 với 1 electron.Nguyên tử khí hiếm
Nguyên tử của các khí hiếm (như He, Ne, Ar,…) có lớp electron ngoài cùng bão hòa electron (thường là 8 electron, trừ heli chỉ có 2 electron). Điều này làm cho chúng rất bền và ít tham gia phản ứng hóa học. Nhiều nguyên tố khác có xu hướng đạt được cấu hình electron bền vững của khí hiếm bằng cách tham gia vào các phản ứng hóa học.Sản phẩm hữu ích: bài họa sĩ hươu lớp 2
Xem thêm: hình học lớp 10
Sản phẩm hữu ích: cuối tuần là thứ mấy
Xem thêm: ancol đa chức là gì
Sản phẩm liên quan: the tích hình chóp