H2SO4 đặc + S
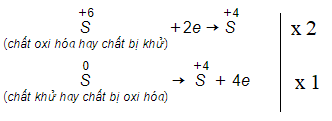

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Axit sunfuric đặc (H2SO4 đặc) phản ứng với lưu huỳnh (S) tạo ra khí sulfur dioxide (SO2) và nước (H2O). Đây là phản ứng oxi hóa khử, trong đó H2SO4 đặc đóng vai trò là chất oxi hóa mạnh.
Phản ứng của H2SO4 đặc với Lưu huỳnh
Phương trình phản ứng
Phương trình phản ứng hóa học cân bằng là: 2H2SO4(đặc) + S → 3SO2 + 2H2O
Cơ chế phản ứng
Trong phản ứng này, lưu huỳnh bị oxi hóa từ số oxi hóa 0 lên +4 trong SO2, còn một phần lưu huỳnh trong H2SO4 bị khử từ số oxi hóa +6 xuống +4 trong SO2. Phản ứng cần được đun nóng để xảy ra. H2SO4 đặc đóng vai trò chất oxi hóa mạnh do tính oxi hóa mạnh của ion sunfat (SO42-) trong môi trường axit đậm đặc.
Hiện tượng quan sát được
Khi cho lưu huỳnh vào H2SO4 đặc và đun nóng, ta sẽ quan sát thấy:
- Lưu huỳnh tan dần.
- Có khí mùi hắc (SO2) thoát ra.
- Dung dịch có thể chuyển màu hơi vàng nhạt do sự tạo thành SO2.
Ứng dụng
Phản ứng này không được ứng dụng rộng rãi trong công nghiệp, tuy nhiên, nó minh họa rõ nét về tính chất oxi hóa mạnh của H2SO4 đặc và giúp hiểu rõ hơn về phản ứng oxi hóa khử.
Lưu ý an toàn
Lưu huỳnh và axit sunfuric đặc đều là chất gây hại. Phản ứng cần được thực hiện trong điều kiện phòng thí nghiệm có đủ thiết bị bảo hộ và thông gió tốt để tránh hít phải khí SO2 độc hại. Sử dụng găng tay, kính bảo hộ và áo choàng phòng thí nghiệm là cần thiết.
Sản phẩm liên quan: bờ bãi là từ ghép hay từ láy
Sản phẩm liên quan: 1 tuần tăng 7kg
Sản phẩm liên quan: công thức hóa học của khí metan
Xem thêm: lewis structure of so42-