Fe + H2SO4 loãng: Phản ứng và ứng dụng

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Sắt (Fe) phản ứng với axit sunfuric loãng (H2SO4) tạo ra muối sắt(II) sunfat (FeSO4) và khí hiđro (H2). Đây là phản ứng thế đơn giản và thường được dùng trong phòng thí nghiệm để điều chế khí hiđro.
Phản ứng của Fe với H2SO4 loãng
Phương trình phản ứng:
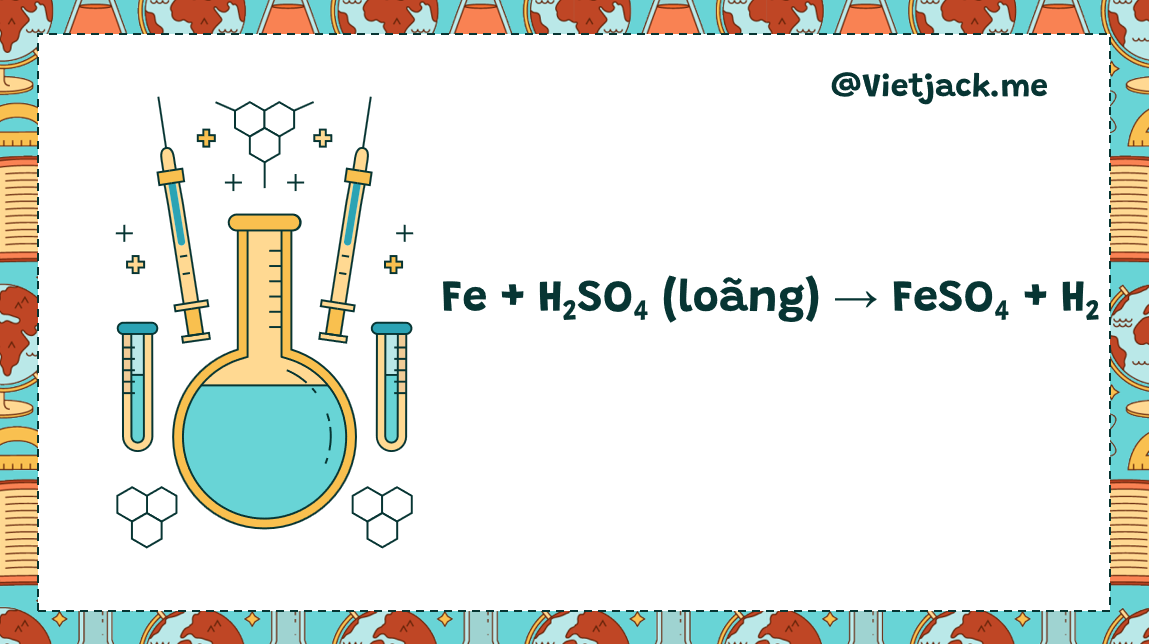
Fe + H2SO4(loãng) → FeSO4 + H2 Phản ứng này xảy ra ở điều kiện thường, không cần đun nóng. Sắt bị oxi hóa từ số oxi hóa 0 lên +2, trong khi các ion H+ trong axit sunfuric bị khử thành H2. Phản ứng này giải phóng khí hiđro, dễ nhận biết bằng cách đốt cháy khí tạo ra tiếng nổ nhỏ.Đặc điểm phản ứng:
- Phản ứng xảy ra khá nhanh.
- Dung dịch sau phản ứng có màu xanh nhạt đặc trưng của muối sắt(II) sunfat.
- Khí hiđro sinh ra có thể được thu bằng phương pháp đẩy nước hoặc đẩy không khí.
Ứng dụng của phản ứng Fe + H2SO4 loãng
Điều chế khí hiđro:
Đây là ứng dụng quan trọng nhất của phản ứng này. Khí hiđro thu được có thể được sử dụng trong nhiều ứng dụng khác nhau, chẳng hạn như: nhiên liệu, hàn cắt kim loại, tổng hợp amoniac,...Điều chế muối sắt(II) sunfat:
Muối sắt(II) sunfat (FeSO4) là một hợp chất hóa học quan trọng, được sử dụng làm chất khử, thuốc nhuộm, chất phụ gia trong công nghiệp thực phẩm,... Phản ứng giữa sắt và axit sunfuric loãng là một phương pháp đơn giản để điều chế muối này.Trong giáo dục:
Phản ứng này thường được sử dụng trong các bài thực hành hóa học ở cấp trung học cơ sở và trung học phổ thông để minh họa cho phản ứng thế, tính chất hóa học của kim loại và axit.Sản phẩm liên quan: thí nghiệm của thomson
Xem thêm: tính tổng cấp số nhân lùi vô hạn
Sản phẩm hữu ích: on tập toán lớp 3 học kì 2 có đáp án
Sản phẩm liên quan: độ c qua độ f
Sản phẩm hữu ích: 101 bài toán nâng cao lớp 3 có đáp an