Công thức tính hóa trị


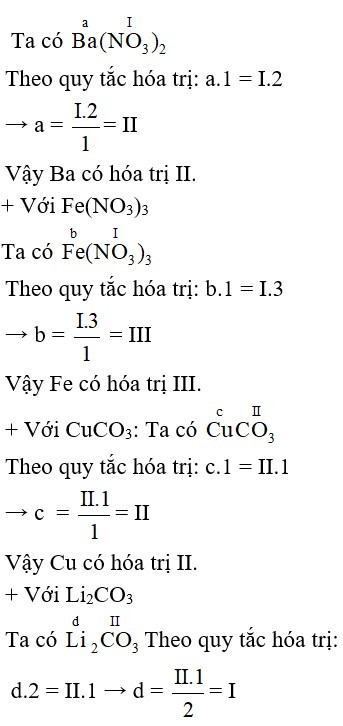
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Công thức tính hóa trị phụ thuộc vào loại hợp chất. Đối với hợp chất cộng hóa trị, ta dựa vào số electron dùng chung. Đối với hợp chất ion, ta dựa vào điện tích ion. Tóm lại, không có một công thức duy nhất áp dụng cho tất cả trường hợp.
Tính hóa trị trong hợp chất ion
Điện tích ion và hóa trị
Trong hợp chất ion, hóa trị của một nguyên tố bằng độ lớn của điện tích ion của nguyên tố đó. Ví dụ: Ion Na+ có hóa trị I, ion Ca2+ có hóa trị II, ion Cl- có hóa trị I, ion O2- có hóa trị II. Để xác định hóa trị trong hợp chất ion, ta cần biết điện tích của các ion tạo nên hợp chất.Tính hóa trị trong hợp chất cộng hóa trị
Số electron dùng chung và hóa trị
Trong hợp chất cộng hóa trị, hóa trị của một nguyên tố được xác định bằng số liên kết cộng hóa trị mà nguyên tử của nguyên tố đó tạo ra. Số liên kết cộng hóa trị được tính bằng số cặp electron dùng chung giữa các nguyên tử. Ví dụ: Trong phân tử nước (H2O), nguyên tử O tạo 2 liên kết cộng hóa trị với 2 nguyên tử H, do đó hóa trị của O là II, và hóa trị của H là I. Để xác định hóa trị trong hợp chất cộng hóa trị, cần vẽ công thức Lewis để xác định số cặp electron dùng chung. Lưu ý: Hóa trị có thể khác nhau tùy thuộc vào hợp chất mà nguyên tố tham gia. Ví dụ, sắt (Fe) có thể có hóa trị II hoặc III tùy thuộc vào hợp chất. Việc xác định hóa trị chính xác đòi hỏi sự hiểu biết về cấu tạo phân tử và liên kết hóa học.Sản phẩm hữu ích: lịch thi toán violympic
Sản phẩm hữu ích: hoa mi hot hay
Xem thêm: quy tắc hình hộp chữ nhật
Xem thêm: balance mno4- + i-