Phương trình phản ứng cân bằng MnO4- + I-
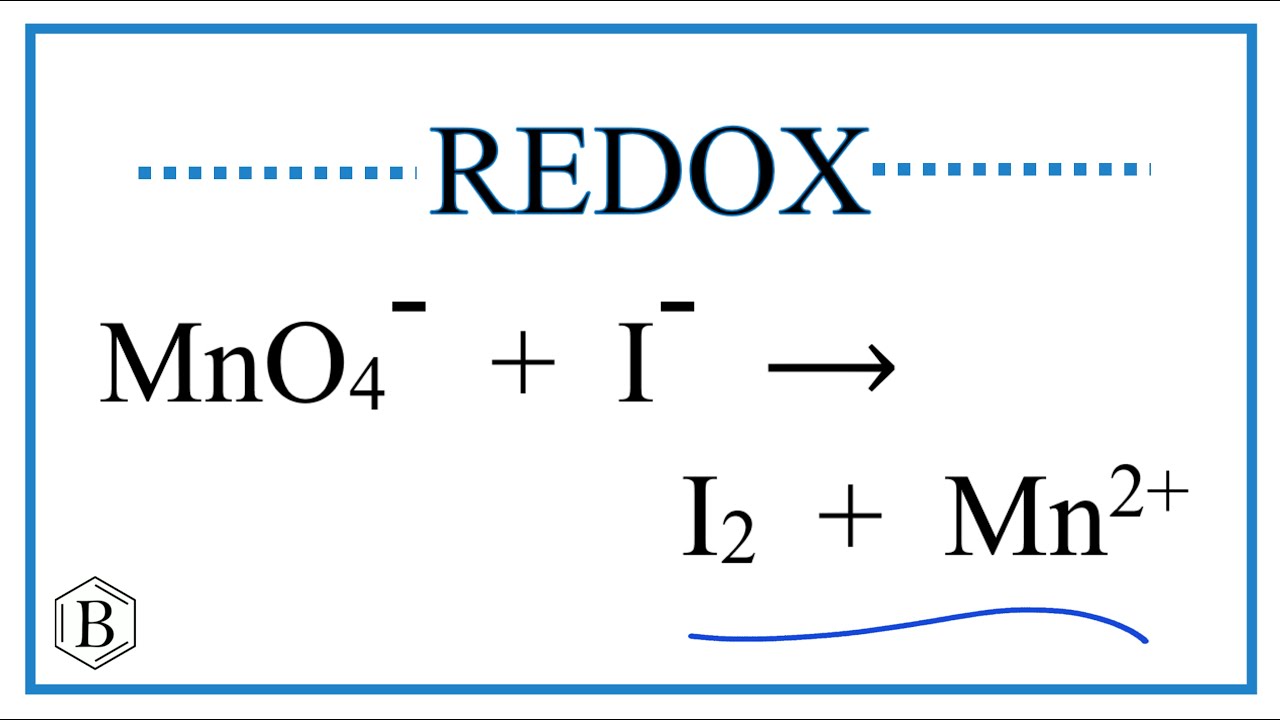

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa ion permanganat (MnO4-) và ion iodua (I-) là một phản ứng oxi hóa khử, trong đó MnO4- bị khử và I- bị oxi hóa. Phương trình cân bằng phụ thuộc vào môi trường phản ứng (axit, trung tính hay kiềm).
Cân bằng phản ứng trong môi trường axit
Phương trình ion rút gọn:
2MnO4- + 16H+ + 10I- → 2Mn2+ + 5I2 + 8H2O
Giải thích:
Trong môi trường axit, ion permanganat (MnO4-) bị khử từ số oxi hóa +7 xuống +2 (Mn2+), trong khi ion iodua (I-) bị oxi hóa từ số oxi hóa -1 lên 0 (I2). Để cân bằng điện tích và số nguyên tử, ta cần thêm ion H+ và H2O.
Cân bằng phản ứng trong môi trường trung tính hoặc kiềm
Cân bằng phản ứng trong môi trường trung tính hoặc kiềm phức tạp hơn và sản phẩm tạo thành có thể khác nhau tùy thuộc vào điều kiện phản ứng cụ thể. Thông thường, MnO4- sẽ bị khử thành MnO2 (số oxi hóa +4) thay vì Mn2+.
Ví dụ cân bằng (môi trường kiềm):
2MnO4- + H2O + I- → 2MnO2 + 2OH- + IO3-
Lưu ý: Phương trình này cần kiểm tra lại sự cân bằng, do đây chỉ là ví dụ minh họa. Cân bằng chính xác phụ thuộc vào điều kiện phản ứng cụ thể và cần được xác định thông qua thực nghiệm hoặc phương pháp cân bằng phản ứng oxi hoá khử phức tạp hơn.
Để cân bằng chính xác phản ứng trong môi trường trung tính hoặc kiềm, bạn cần áp dụng phương pháp nửa phản ứng hoặc phương pháp thay đổi số oxi hoá. Các phương pháp này đòi hỏi sự hiểu biết sâu hơn về hoá học oxi hoá khử.
Xem thêm: sau sinh ăn được măng cụt không
Xem thêm: tài liệu luyện đọc tiếng trung
Sản phẩm liên quan: đáp án 600 câu hỏi b2