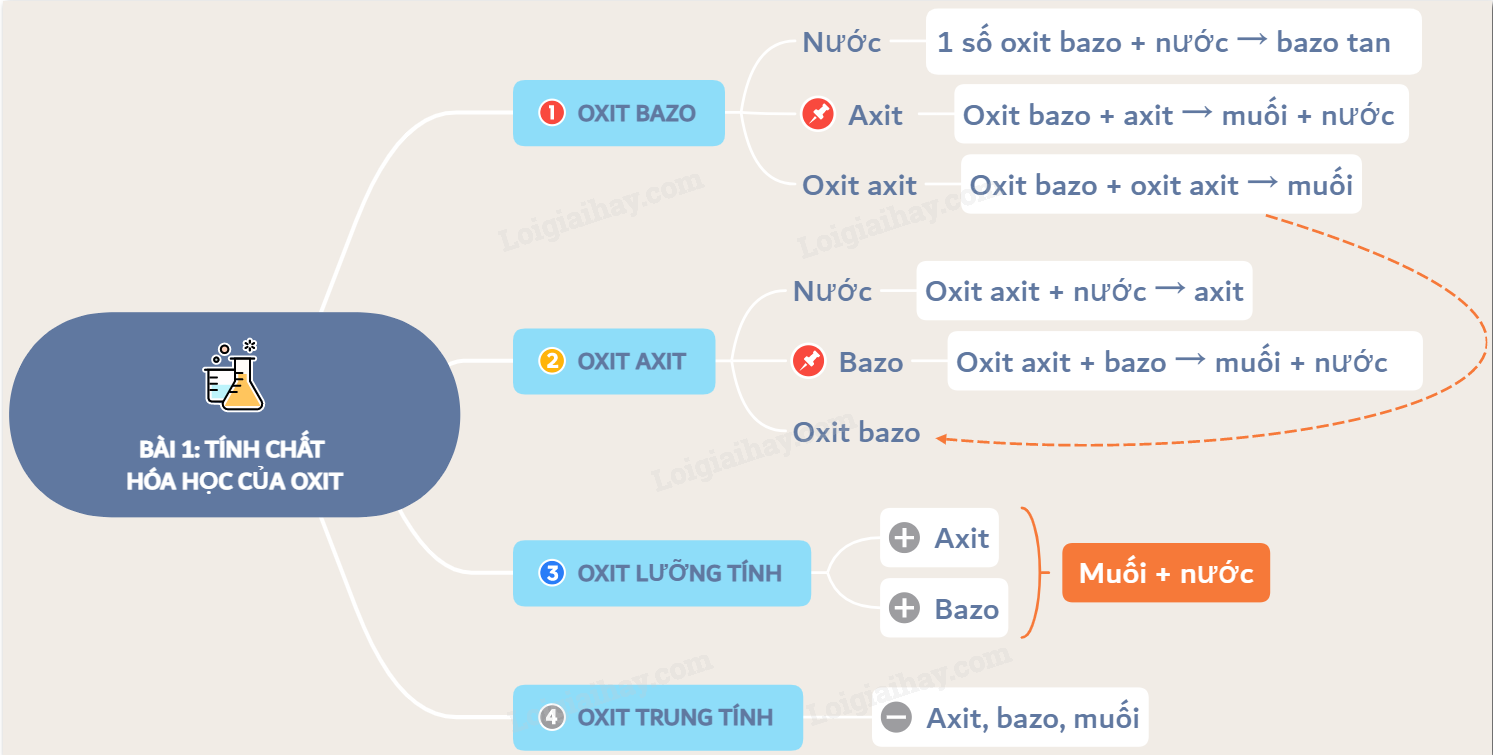
CO là oxit trung tính


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
CO là oxit trung tính vì nó không phản ứng với cả axit và bazơ. Nó không thể hiện tính chất của một oxit axit (tạo thành axit khi tác dụng với nước) hay một oxit bazơ (tạo thành bazơ khi tác dụng với nước).
Tính chất hóa học của CO
Không phản ứng với nước:
CO không phản ứng với nước ở điều kiện thường. Điều này khác biệt với nhiều oxit axit khác như SO2, CO2, ... tạo ra axit tương ứng khi tác dụng với nước.Phản ứng với oxi:
CO cháy trong oxi tạo ra khí cacbonic (CO2): 2CO + O2 → 2CO2. Phản ứng này tỏa nhiệt mạnh.Phản ứng khử oxit kim loại:
CO thể hiện tính khử mạnh khi tác dụng với một số oxit kim loại ở nhiệt độ cao, ví dụ: Fe2O3 + 3CO → 2Fe + 3CO2. Đây là phản ứng quan trọng trong luyện kim.Phản ứng với các chất oxi hóa khác:
CO có thể phản ứng với các chất oxi hóa khác như clo, tạo thành phosgen (COCl2) – một chất khí cực độc.Sự khác biệt giữa CO và các oxit khác
CO khác biệt với các oxit axit như CO2, SO2, ... vì không phản ứng với nước tạo axit. Nó cũng khác với các oxit bazơ như Na2O, CaO, ... vì không phản ứng với nước tạo bazơ. Chính vì không thể hiện tính axit hay bazơ nên CO được phân loại là oxit trung tính.Ứng dụng của CO
Mặc dù có độc tính, CO vẫn có nhiều ứng dụng quan trọng trong công nghiệp, như: * Làm chất khử trong luyện kim. * Sản xuất metanol. * Sử dụng trong các ngành công nghiệp hóa chất khác. Lưu ý: CO là một chất khí rất độc, hít phải một lượng nhỏ CO cũng có thể gây nguy hiểm đến tính mạng. Cần hết sức thận trọng khi làm việc với CO.Sản phẩm liên quan: trọng tâm của tam giác là giao điểm của
Sản phẩm liên quan: rượu tên hóa học là gì
Sản phẩm liên quan: chính tả lớp 3 kết nối