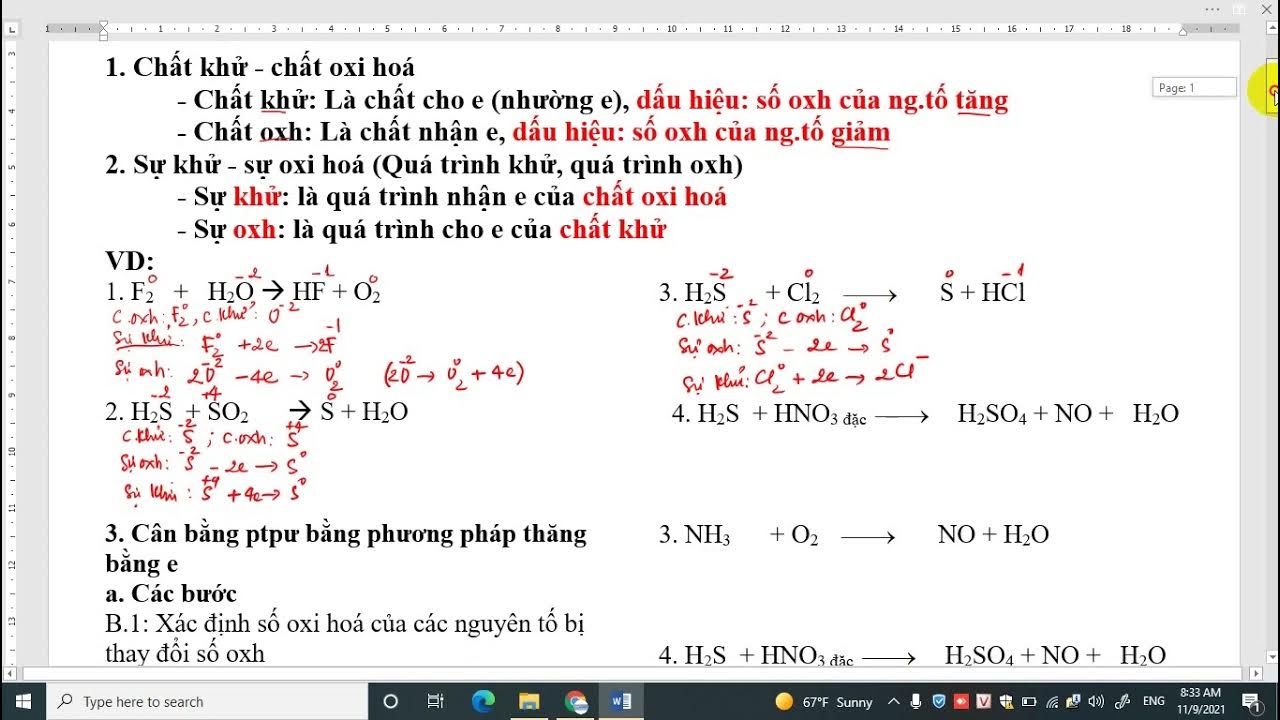
Cân bằng phương trình phản ứng bằng phương pháp thăng bằng electron
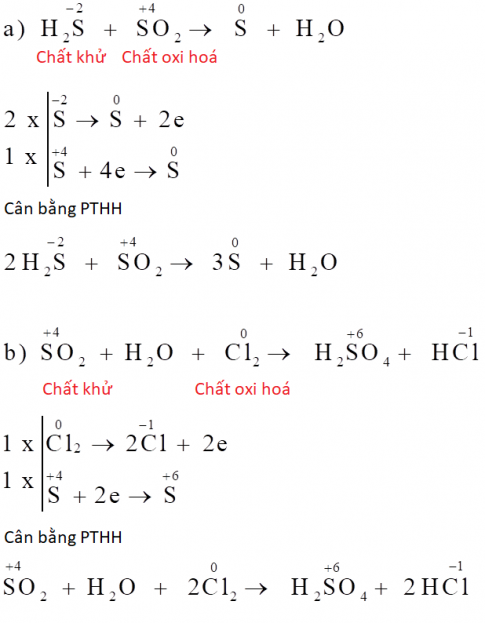
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Cân bằng phương trình phản ứng bằng phương pháp thăng bằng electron là phương pháp giúp xác định hệ số của các chất tham gia và sản phẩm trong một phản ứng oxi hóa khử, dựa trên nguyên tắc bảo toàn electron. Phương pháp này dựa trên việc cân bằng số electron nhường và electron nhận trong phản ứng.
Các bước cân bằng phương trình phản ứng bằng phương pháp thăng bằng electron
Bước 1: Xác định số oxi hóa của các nguyên tố
Trong bước này, bạn cần xác định số oxi hóa của từng nguyên tố trong các chất tham gia và sản phẩm. Số oxi hóa thay đổi cho thấy sự oxi hóa hoặc khử đã xảy ra.Bước 2: Xác định chất oxi hóa và chất khử
Chất khử là chất nhường electron, số oxi hóa tăng lên. Chất oxi hóa là chất nhận electron, số oxi hóa giảm xuống.Bước 3: Viết các bán phản ứng
Viết riêng các bán phản ứng oxi hóa và khử. Cân bằng các nguyên tử khác ngoài oxi và hydro trong mỗi bán phản ứng.Bước 4: Cân bằng electron
Cân bằng số electron nhường và nhận bằng cách nhân các bán phản ứng với các hệ số thích hợp.Bước 5: Cân bằng các nguyên tử còn lại
Cân bằng các nguyên tử còn lại (thường là oxi và hydro) bằng cách thêm H+, OH- hoặc H2O vào các bán phản ứng. Điều này phụ thuộc vào môi trường phản ứng (axit, bazơ hoặc trung tính).Bước 6: Tổng hợp các bán phản ứng
Cộng hai bán phản ứng lại với nhau, đơn giản hóa các ion hoặc phân tử trùng lặp ở hai vế. Kiểm tra lại xem phương trình đã cân bằng về số lượng nguyên tử mỗi nguyên tố. Ví dụ: Cân bằng phương trình phản ứng sau trong môi trường axit: MnO4- + Fe2+ → Mn2+ + Fe3+ Bước 1: Xác định số oxi hóa: Mn (+7) → Mn (+2); Fe (+2) → Fe (+3) Bước 2: Chất oxi hóa: MnO4-; Chất khử: Fe2+ Bước 3: Bán phản ứng: MnO4- + 5e- + 8H+ → Mn2+ + 4H2O Fe2+ → Fe3+ + e- Bước 4: Cân bằng electron: Nhân bán phản ứng thứ hai với 5: 5Fe2+ → 5Fe3+ + 5e- Bước 5: Cân bằng đã hoàn chỉnh. Bước 6: Tổng hợp: MnO4- + 5Fe2+ + 8H+ → Mn2+ + 5Fe3+ + 4H2O Phương trình phản ứng đã được cân bằng. Việc thực hành nhiều bài tập sẽ giúp bạn thành thạo phương pháp này.Sản phẩm liên quan: phiếu bài tập toán lớp 2 kết nối tri thức
Sản phẩm hữu ích: tổng hợp lý thuyết hình học lớp 8
Sản phẩm hữu ích: hợp chất nào sau đây vừa tác dụng được với dung dịch hcl vừa tác dụng được với dung dịch naoh
Sản phẩm hữu ích: trái vú sữa tiếng anh