Cân bằng phương trình Al + HNO3 = Al(NO3)3 + N2O + H2O
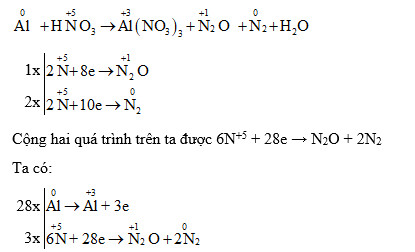

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa nhôm (Al) và axit nitric (HNO3) tạo ra nhôm nitrat [Al(NO3)3], đi nitơ oxit (N2O) và nước (H2O) là một phản ứng oxi hóa khử phức tạp. Để cân bằng phương trình Al + HNO3 = Al(NO3)3 + N2O + H2O, ta cần xác định số oxi hóa của các nguyên tử và cân bằng số nguyên tử mỗi nguyên tố ở hai vế. Phương trình cân bằng là: 4Al + 10HNO3 → 4Al(NO3)3 + N2O + 5H2O
Phương pháp cân bằng phương trình phản ứng oxi hóa khử
Phân tích số oxi hóa
Để cân bằng phương trình này, chúng ta cần sử dụng phương pháp cân bằng electron. Đầu tiên, xác định số oxi hóa của các nguyên tố trong phản ứng: * Al: số oxi hóa tăng từ 0 lên +3 (Al → Al3+ + 3e-) * N trong HNO3: số oxi hóa giảm từ +5 xuống +1 (2N+5 + 8e- → 2N+1)Cân bằng electron
Nhân hệ số thích hợp cho mỗi nửa phản ứng để số electron nhường bằng số electron nhận: * 8Al → 8Al3+ + 24e- * 3(2N+5 + 8e- → 2N+1) → 6N+5 + 24e- → 6N+1Cân bằng nguyên tử
Sau khi cân bằng electron, ta có: 8Al + 6HNO3 → 8Al(NO3)3 + 3N2O + ...H2O Tiếp tục cân bằng số nguyên tử nitơ và hiđro: 8Al + 10HNO3 → 8Al(NO3)3 + 3N2O + 5H2O Cuối cùng, ta rút gọn hệ số để được phương trình cân bằng tối giản: 4Al + 10HNO3 → 4Al(NO3)3 + N2O + 5H2OĐiều kiện phản ứng
Phản ứng này thường xảy ra ở điều kiện phản ứng đặc biệt, chẳng hạn như HNO3 loãng, nóng. Điều kiện phản ứng ảnh hưởng đến sản phẩm tạo thành.Xem thêm: chất béo là gì hóa 12
Xem thêm: thế nào là từ đồng âm
Xem thêm: số cộng và số bị cộng