Các Phân Lớp Electron
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
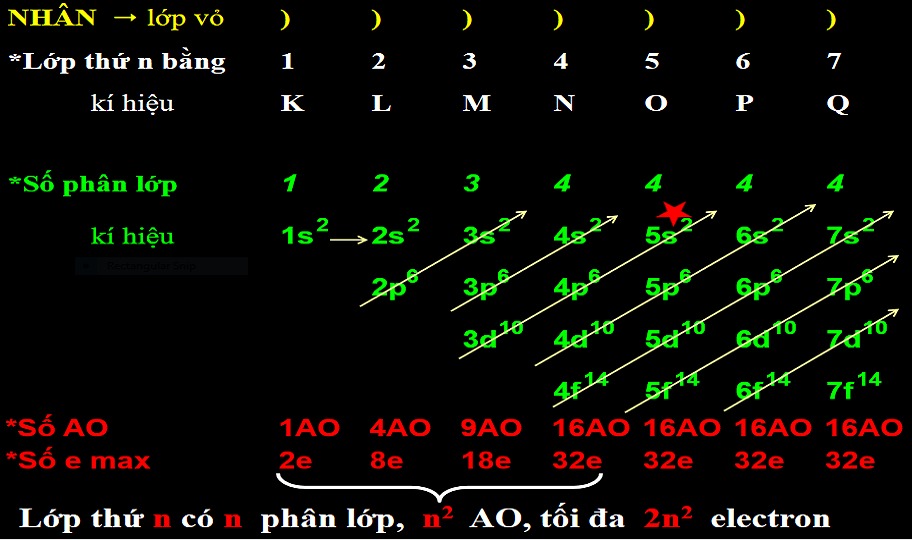
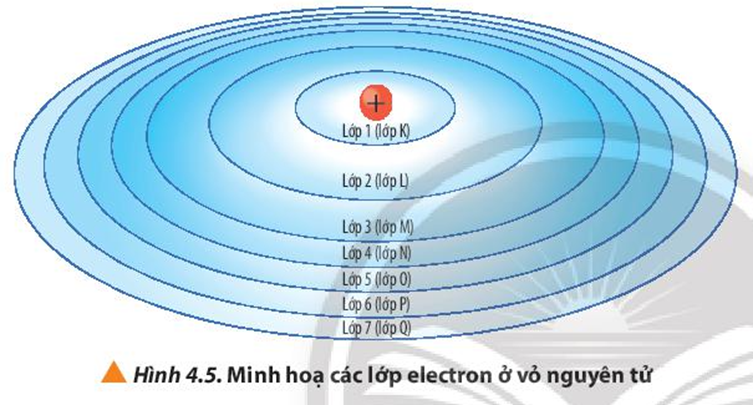
Các phân lớp electron là các vùng không gian xung quanh hạt nhân nguyên tử nơi có xác suất tìm thấy electron cao nhất. Chúng được ký hiệu bằng các chữ cái s, p, d và f, mỗi phân lớp có hình dạng và số lượng electron tối đa khác nhau. Việc hiểu về các phân lớp electron là rất quan trọng để hiểu cấu hình electron của nguyên tử và do đó là tính chất hóa học của chúng.
Phân loại các phân lớp electron
Phân lớp s:
Phân lớp s có hình dạng cầu, chứa tối đa 2 electron. Mỗi lớp electron chỉ có một phân lớp s.Phân lớp p:
Phân lớp p có hình dạng như hai thùy đối xứng nhau, chứa tối đa 6 electron. Bắt đầu từ lớp thứ 2 (n=2), mỗi lớp electron có một phân lớp p.Phân lớp d:
Phân lớp d có hình dạng phức tạp hơn, chứa tối đa 10 electron. Bắt đầu từ lớp thứ 3 (n=3), mỗi lớp electron có một phân lớp d.Phân lớp f:
Phân lớp f có hình dạng rất phức tạp, chứa tối đa 14 electron. Bắt đầu từ lớp thứ 4 (n=4), mỗi lớp electron có một phân lớp f.Số lượng electron tối đa trong mỗi phân lớp
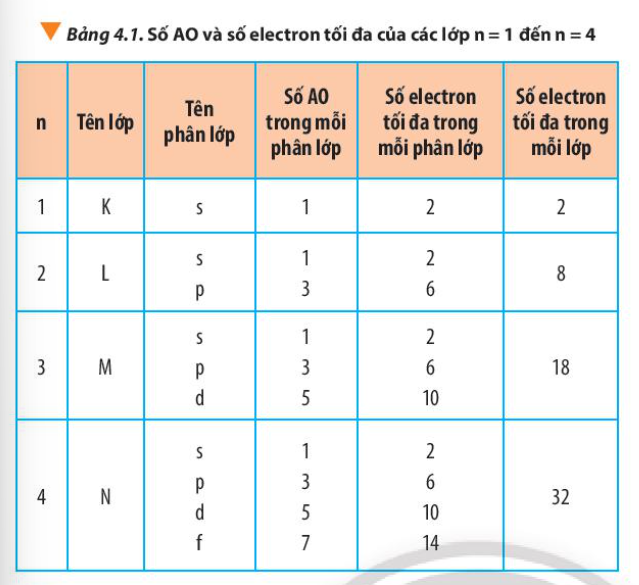
Như đã đề cập ở trên, mỗi phân lớp có số lượng electron tối đa như sau:
- Phân lớp s: 2 electron
- Phân lớp p: 6 electron
- Phân lớp d: 10 electron
- Phân lớp f: 14 electron
Ứng dụng của việc hiểu về phân lớp electron
Việc hiểu biết về các phân lớp electron giúp chúng ta:
- Dự đoán được cấu hình electron của nguyên tử.
- Giải thích được tính chất hóa học của các nguyên tố.
- Hiểu rõ hơn về liên kết hóa học.
- Ứng dụng trong nhiều lĩnh vực khoa học khác như vật lý, công nghệ nano…
Xem thêm: các chất được cấu tạo như thế nào lý 8
Xem thêm: hằng đẳng thức học lớp mấy
Sản phẩm liên quan: tính chất của naoh
Xem thêm: thành lũy là gì