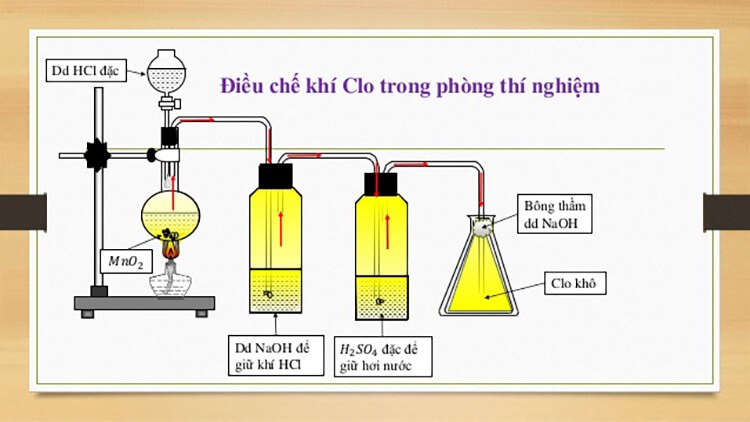
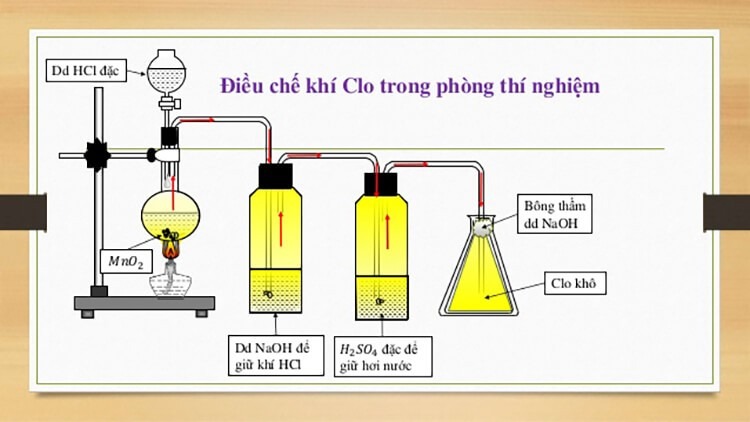
Trong phòng thí nghiệm clo được điều chế bằng cách cho HCl đặc phản ứng với
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Trong phòng thí nghiệm, clo thường được điều chế bằng cách cho axit clohydric (HCl) đặc phản ứng với một chất oxi hóa mạnh. Chất oxi hóa thường được sử dụng là mangan đioxit (MnO2) hoặc kali pemanganat (KMnO4).
Phương trình phản ứng và cách tiến hành
Điều chế clo từ HCl đặc và MnO2
Phản ứng giữa HCl đặc và MnO2 tạo ra khí clo, nước và muối mangan(II) clorua: MnO2(r) + 4HCl(đặc) → MnCl2(dd) + Cl2(k) + 2H2O(l) Để thực hiện, ta cho MnO2 vào bình cầu đáy tròn, thêm HCl đặc vào. Đậy bình bằng nút cao su có gắn ống dẫn khí và ống nhỏ giọt. Khí clo được dẫn qua nước để loại bỏ HCl hòa tan và thu khí clo bằng phương pháp đẩy không khí (vì clo nặng hơn không khí). Cần lưu ý rằng clo là khí độc, nên thí nghiệm cần được thực hiện trong tủ hút hoặc nơi thông thoáng.Điều chế clo từ HCl đặc và KMnO4
Kali pemanganat cũng là một chất oxi hóa mạnh có thể phản ứng với HCl đặc để tạo ra clo: 2KMnO4(r) + 16HCl(đặc) → 2KCl(dd) + 2MnCl2(dd) + 5Cl2(k) + 8H2O(l) Cách tiến hành tương tự như với MnO2, tuy nhiên cần chú ý đến tính oxi hóa mạnh hơn của KMnO4, cần thao tác cẩn thận hơn. Cả hai phương pháp trên đều cho phép điều chế được khí clo trong phòng thí nghiệm. Tuy nhiên, phương pháp sử dụng MnO2 thường được lựa chọn vì dễ kiếm hơn và ít nguy hiểm hơn so với KMnO4. Việc thu khí clo cần được thực hiện cẩn thận để tránh rò rỉ và đảm bảo an toàn.Sản phẩm hữu ích: barem chấm điểm môn văn
Sản phẩm liên quan: toán lớp 3 cơ bản
Sản phẩm liên quan: chuyển nhánh trong git