Tính Oxi Hóa Là Gì?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
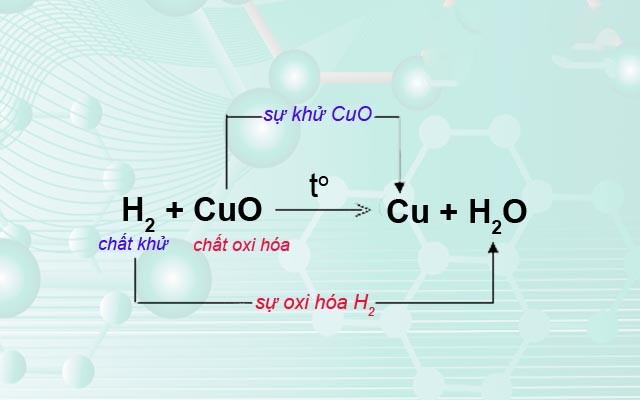
Tính oxi hóa là khả năng của một chất để nhận electron từ một chất khác, dẫn đến sự giảm số oxi hóa của chất đó và sự oxi hóa của chất cho electron. Nói một cách đơn giản, đó là khả năng "cướp" electron từ các nguyên tử hoặc phân tử khác. Chất có tính oxi hóa mạnh sẽ dễ dàng nhận electron hơn so với chất có tính oxi hóa yếu.
Các yếu tố ảnh hưởng đến tính oxi hóa
Điện thế khử
Điện thế khử chuẩn (E0) của một chất phản ánh khả năng nhận electron của nó. Chất có điện thế khử chuẩn càng dương thì tính oxi hóa càng mạnh.Độ âm điện
Độ âm điện là khả năng hút electron của một nguyên tử trong phân tử. Nguyên tử có độ âm điện cao thường có xu hướng nhận electron và thể hiện tính oxi hóa mạnh.Trạng thái oxi hóa
Trạng thái oxi hóa của một nguyên tố trong một hợp chất ảnh hưởng đến khả năng nhận thêm electron. Ví dụ, Mn7+ (trong KMnO4) có tính oxi hóa mạnh hơn Mn2+.Môi trường phản ứng
Môi trường axit hay bazơ có thể ảnh hưởng đến tính oxi hóa của một chất. Ví dụ, KMnO4 có tính oxi hóa mạnh hơn trong môi trường axit so với môi trường trung tính.Ví dụ về tính oxi hóa
Nhiều chất có tính oxi hóa mạnh, ví dụ như:Oxi (O2)
Oxi là chất oxi hóa rất mạnh, tham gia vào rất nhiều phản ứng oxi hóa trong tự nhiên và công nghiệp.Flo (F2)
Flo là chất oxi hóa mạnh nhất, có khả năng oxi hóa hầu hết các chất.Axit nitric (HNO3)
Axit nitric là một chất oxi hóa mạnh, được sử dụng rộng rãi trong công nghiệp hóa chất.Kali pemanganat (KMnO4)
Kali pemanganat là một chất oxi hóa mạnh, được sử dụng trong nhiều lĩnh vực như y tế, công nghiệp và phòng thí nghiệm. Hiểu về tính oxi hóa là rất quan trọng trong nhiều lĩnh vực, từ hóa học, sinh học đến công nghệ môi trường. Việc nắm vững khái niệm này giúp chúng ta hiểu rõ hơn về các phản ứng hóa học và ứng dụng của chúng trong thực tiễn.Sản phẩm liên quan: vẽ hình và mô tả hiện tượng khi ánh sáng truyền từ không khí vào nước
Sản phẩm liên quan: cho caoh2 vào dung dịch nahco3 hiện tượng hóa học là
Sản phẩm liên quan: lực đàn hồi xuất hiện khi