Tính chất hóa học kim loại

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Tính chất hóa học của kim loại chủ yếu dựa trên xu hướng dễ mất electron ở lớp ngoài cùng để đạt được cấu hình electron bền vững. Điều này dẫn đến khả năng tạo ra các ion dương và tham gia vào các phản ứng oxi hóa khử. Kim loại có tính khử mạnh, nghĩa là chúng dễ bị oxi hóa.
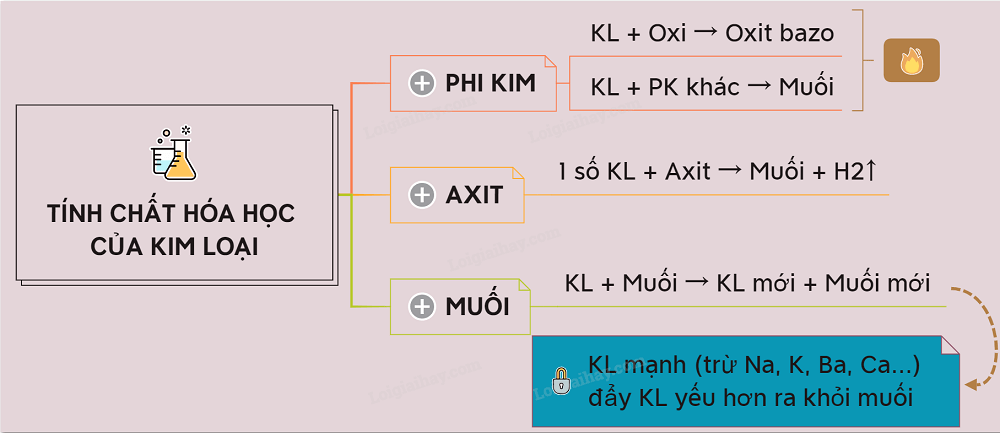
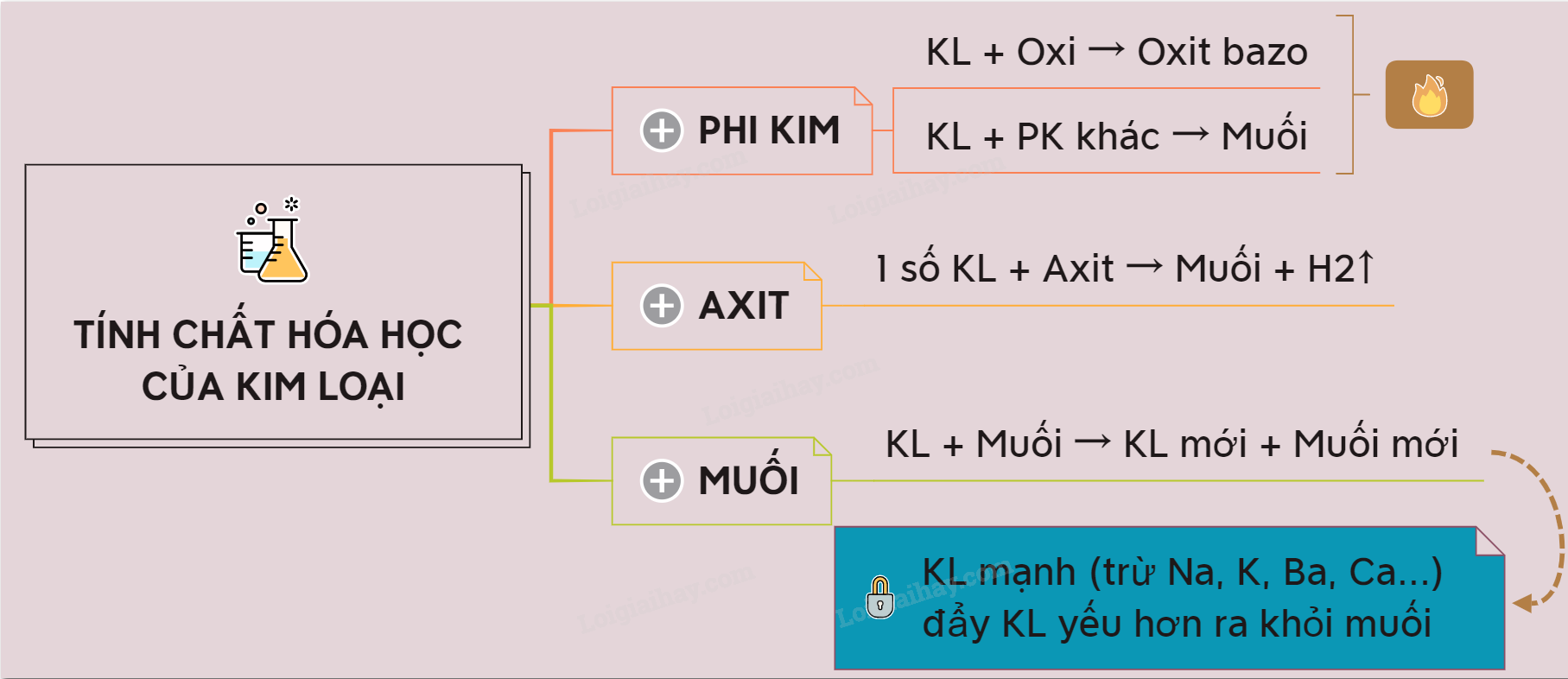
Tính khử của kim loại
Phản ứng với phi kim:
Kim loại phản ứng với oxi, clo, lưu huỳnh... tạo thành oxit, muối clorua, sunfua... Ví dụ: 2Na + Cl2 → 2NaCl; 2Mg + O2 → 2MgO. Tính khử của kim loại càng mạnh thì phản ứng xảy ra càng dễ dàng và mãnh liệt.Phản ứng với nước:
Một số kim loại mạnh như natri, kali, canxi phản ứng mãnh liệt với nước ở điều kiện thường, giải phóng khí hiđro. Ví dụ: 2Na + 2H2O → 2NaOH + H2. Kim loại khác có thể phản ứng với nước ở nhiệt độ cao.Phản ứng với axit:
Hầu hết các kim loại phản ứng với axit (HCl, H2SO4 loãng) giải phóng khí hiđro. Tuy nhiên, một số kim loại như đồng, bạc, vàng không phản ứng với axit HCl, H2SO4 loãng. Ví dụ: Fe + 2HCl → FeCl2 + H2.Phản ứng với dung dịch muối:
Kim loại mạnh hơn có thể đẩy kim loại yếu hơn ra khỏi dung dịch muối của chúng. Đây là phản ứng thế. Ví dụ: Fe + CuSO4 → FeSO4 + Cu. Dãy hoạt động hóa học của kim loại cho biết thứ tự khả năng phản ứng thế của các kim loại.Yếu tố ảnh hưởng đến tính chất hóa học của kim loại
Cấu trúc electron:
Số electron lớp ngoài cùng quyết định khả năng mất electron và tính khử của kim loại. Kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường có tính khử mạnh.Điện tích hạt nhân:
Điện tích hạt nhân càng lớn thì lực hút giữa hạt nhân và electron lớp ngoài cùng càng mạnh, dẫn đến tính khử của kim loại giảm.Bán kính nguyên tử:
Bán kính nguyên tử càng lớn thì electron lớp ngoài cùng càng dễ bị tách ra, dẫn đến tính khử của kim loại tăng.Ứng dụng của tính chất hóa học kim loại
Tính chất hóa học của kim loại được ứng dụng rộng rãi trong công nghiệp, đời sống như sản xuất kim loại, hợp kim, pin, chất xúc tác... Việc hiểu rõ tính chất hóa học của kim loại là rất quan trọng để lựa chọn vật liệu phù hợp cho từng ứng dụng cụ thể.Xem thêm: 5 giai đoạn của đau khổ
Sản phẩm hữu ích: toán lớp 5 trang 100 (diện tích hình tròn)
Sản phẩm hữu ích: cấu hình e của ion fe2+