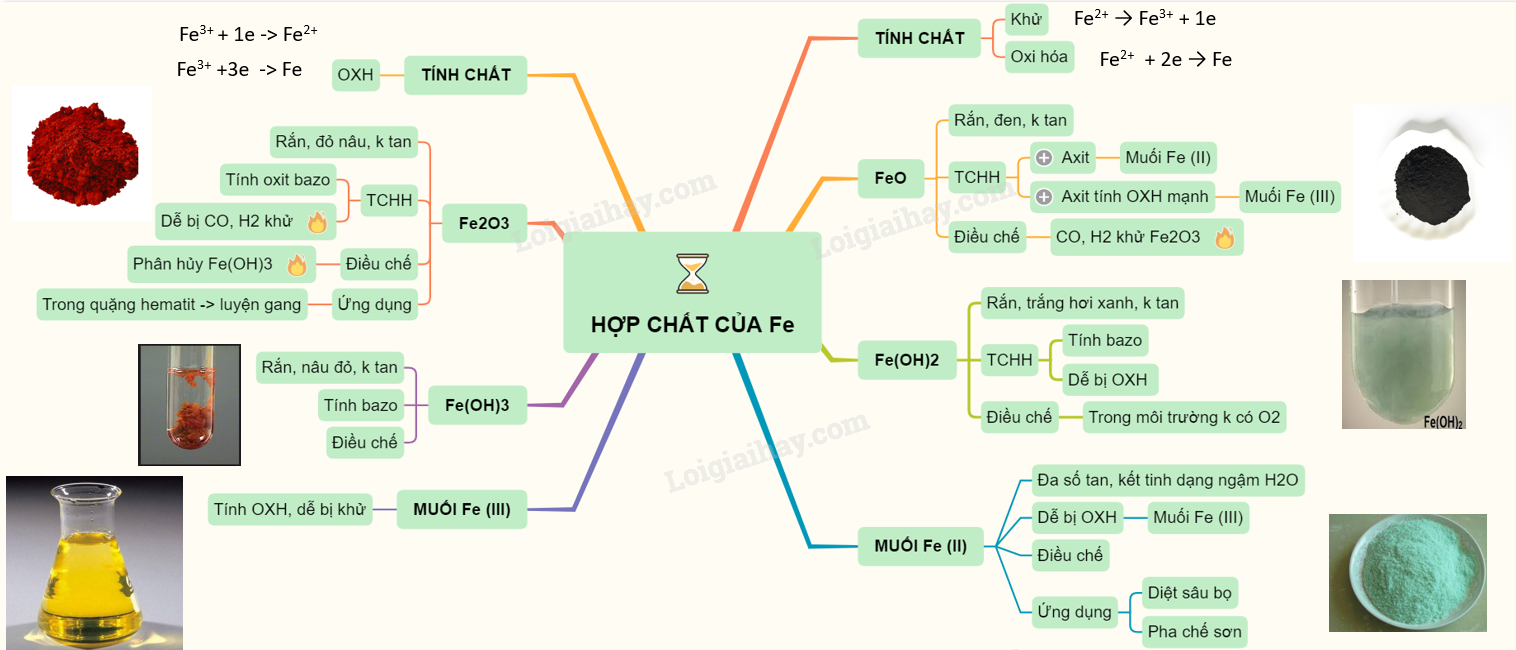
Tính chất hóa học đặc trưng của hợp chất sắt (II)

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Tính chất hóa học đặc trưng của hợp chất sắt (II) là khả năng dễ bị oxi hóa thành hợp chất sắt (III). Sắt (II) có số oxi hóa +2 và có xu hướng nhường 2 electron để đạt được cấu hình electron bền vững. Điều này dẫn đến nhiều phản ứng oxi hóa khử đặc trưng.
Khả năng bị oxi hóa
Tác dụng với oxi
Hợp chất sắt (II) dễ bị oxi hóa bởi oxi trong không khí, đặc biệt khi có mặt nước hoặc axit. Ví dụ, sắt(II) sunfat (FeSO4) khan tương đối bền, nhưng dung dịch FeSO4 dễ bị oxi hóa thành sắt(III) sunfat (Fe2(SO4)3) khi tiếp xúc với không khí. Phản ứng này thường kèm theo sự xuất hiện màu nâu đỏ đặc trưng của ion Fe3+.Tác dụng với các chất oxi hóa khác
Ngoài oxi, hợp chất sắt (II) còn bị oxi hóa bởi nhiều chất oxi hóa khác như clo (Cl2), brom (Br2), axit nitric (HNO3) đậm đặc, kali pemanganat (KMnO4)... Trong các phản ứng này, sắt (II) bị oxi hóa lên sắt (III), còn chất oxi hóa bị khử.Tính khử
Do dễ bị oxi hóa, hợp chất sắt (II) thể hiện tính khử. Nó có thể khử các chất oxi hóa mạnh hơn như ion MnO4- trong môi trường axit.Phản ứng với các chất oxi hóa
Ví dụ, phản ứng giữa dung dịch KMnO4 và FeSO4 trong môi trường axit H2SO4:10FeSO4 + 2KMnO4 + 8H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Phản ứng tạo kết tủa
Một số hợp chất sắt (II) tạo kết tủa khi phản ứng với các chất khác. Ví dụ, khi cho dung dịch NaOH vào dung dịch FeSO4 sẽ tạo ra kết tủa màu trắng xanh Fe(OH)2, dễ bị oxi hóa thành Fe(OH)3 màu nâu đỏ trong không khí. Tóm lại, tính chất hóa học đặc trưng của hợp chất sắt (II) chủ yếu là khả năng bị oxi hóa thành sắt (III) và tính khử tương ứng. Hiểu rõ tính chất này giúp ta giải thích và dự đoán được nhiều phản ứng hóa học liên quan đến hợp chất sắt (II).Xem thêm: bài toán cho bé 5 tuổi
Sản phẩm liên quan: kim loại có những tính chất hóa học nào
Sản phẩm liên quan: come to light là gì
Sản phẩm hữu ích: đi pass là gì
Sản phẩm liên quan: bài hát chuyện tình không dĩ vãng