Tính chất hóa học của H2SO4 loãng
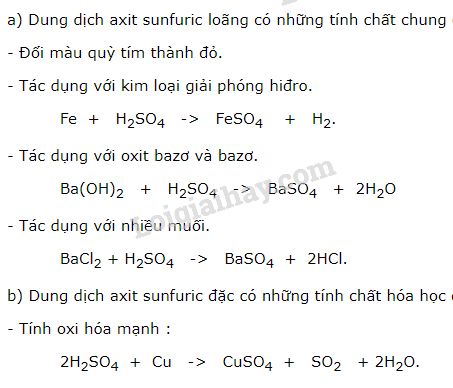
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Axit sunfuric loãng (H2SO4 loãng) là một axit mạnh, tuy nhiên, tính chất hóa học của nó sẽ khác biệt so với H2SO4 đặc. H2SO4 loãng chủ yếu thể hiện tính chất chung của một axit mạnh, đó là làm đổi màu quỳ tím thành đỏ và tác dụng với nhiều chất khác nhau.
Tác dụng với kim loại
Phản ứng với kim loại đứng trước hiđro trong dãy hoạt động hóa học
H2SO4 loãng phản ứng với kim loại đứng trước hiđro (trừ Pb) tạo thành muối sunfat và giải phóng khí hiđro. Ví dụ:
Fe + H2SO4 → FeSO4 + H2↑
Zn + H2SO4 → ZnSO4 + H2↑
Tác dụng với oxit bazơ
Tạo muối và nước
H2SO4 loãng phản ứng với oxit bazơ tạo thành muối sunfat và nước. Ví dụ:
CuO + H2SO4 → CuSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Tác dụng với bazơ
Phản ứng trung hòa tạo muối và nước
H2SO4 loãng phản ứng với bazơ tạo thành muối sunfat và nước. Đây là phản ứng trung hòa.
2NaOH + H2SO4 → Na2SO4 + 2H2O
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
(Lưu ý: BaSO4 là kết tủa trắng)
Tác dụng với muối
Điều kiện xảy ra phản ứng
H2SO4 loãng tác dụng với muối tạo thành muối mới và axit mới nếu sản phẩm tạo thành có chất kết tủa, chất khí bay hơi hoặc tạo thành chất điện li yếu hơn.
Ví dụ: BaCl2 + H2SO4 → BaSO4↓ + 2HCl
(BaSO4 là kết tủa trắng)
Xem thêm: hình tròn ngoại tiếp tam giác
Xem thêm: hóa học có khó không
Sản phẩm hữu ích: tu vi thien binh