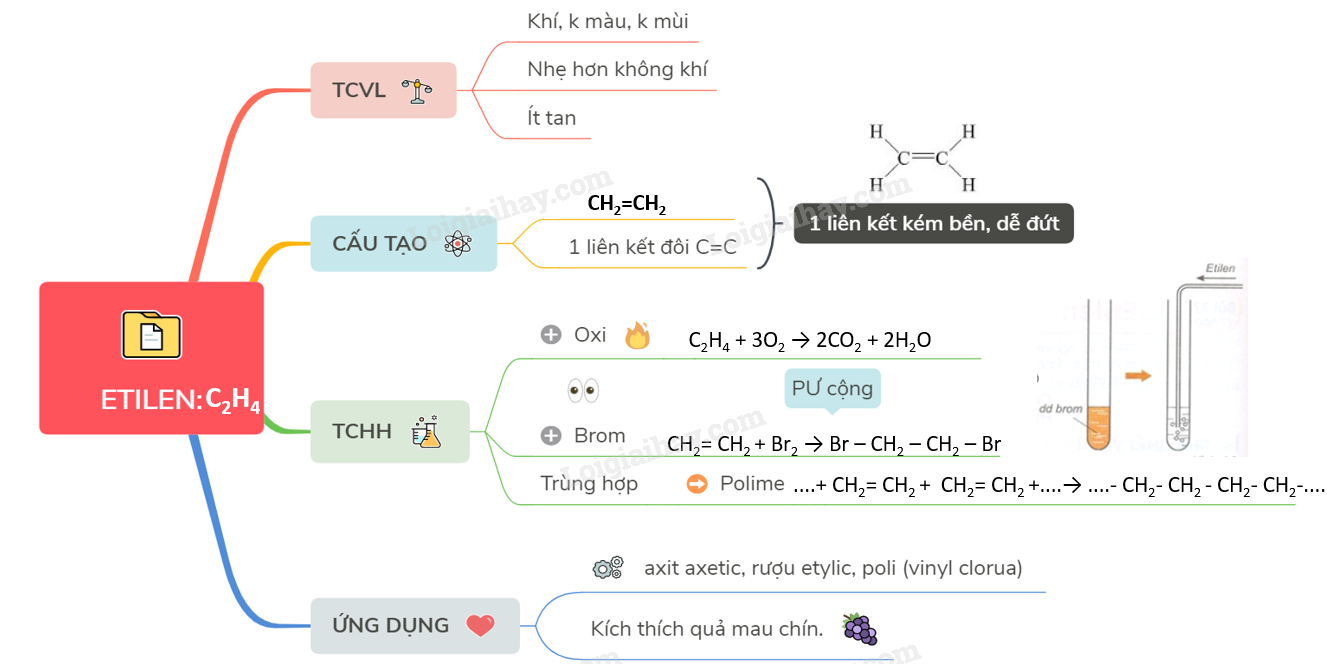
Tính chất hóa học của Etilen
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Etilen (C2H4) là một hiđrocacbon không no, có liên kết đôi C=C trong phân tử, chính vì vậy mà nó có tính chất hóa học đặc trưng là phản ứng cộng. Tìm hiểu chi tiết về tính chất hóa học của etilen sẽ giúp bạn hiểu rõ hơn về phản ứng đặc trưng và ứng dụng quan trọng của nó trong công nghiệp.
Phản ứng cộng
Phản ứng cộng với hiđro (H2)
Etilen phản ứng với hiđro khi có xúc tác Ni, nung nóng tạo ra etan: C2H4 + H2 →Ni, to C2H6. Đây là phản ứng cộng hiđro, làm mất đi liên kết đôi trong phân tử etilen.Phản ứng cộng với halogen (Cl2, Br2, I2)
Etilen phản ứng với brom (Br2) ở điều kiện thường tạo ra 1,2-đibrometan: C2H4 + Br2 → C2H4Br2 (dung dịch Br2 mất màu). Phản ứng này được dùng để nhận biết etilen. Tương tự, etilen cũng phản ứng cộng với clo (Cl2) và iot (I2).Phản ứng cộng với axit halogen hiđric (HCl, HBr, HI)
Etilen phản ứng cộng với axit clohiđric (HCl) tạo ra cloetan: C2H4 + HCl → C2H5Cl. Phản ứng này tuân theo quy tắc cộng Maccopnhicop.Phản ứng oxi hóa
Phản ứng cháy
Etilen cháy trong oxi tạo ra khí cacbonic và hơi nước, tỏa nhiều nhiệt: C2H4 + 3O2 → 2CO2 + 2H2O.Phản ứng oxi hóa hoàn toàn
Etilen bị oxi hóa hoàn toàn bởi các chất oxi hóa mạnh như KMnO4 (dung dịch kali pemanganat) làm mất màu dung dịch KMnO4. Đây là phản ứng oxi hóa không hoàn toàn, không tạo ra CO2 và H2O mà tạo ra các sản phẩm trung gian.Phản ứng trùng hợp
Etilen có thể tham gia phản ứng trùng hợp tạo thành polime polietilen (PE) – một chất dẻo quan trọng trong công nghiệp: nC2H4 → (-CH2-CH2-)n (PE). Đây là phản ứng cộng liên tiếp nhiều phân tử etilen với nhau.Sản phẩm hữu ích: toán lớp 5 bài 83 bảng đơn vị đo thời gian
Sản phẩm liên quan: bài thuyết trình thuyết phục người khác
Xem thêm: gạch ngang chữ trong google doc