Tính chất hóa học cơ bản của sắt
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Tính chất hóa học cơ bản của sắt là khả năng phản ứng với nhiều chất khác nhau, tạo ra các hợp chất sắt khác nhau. Sắt có thể phản ứng với oxi, axit, muối và một số phi kim khác. Cụ thể:
Phản ứng với phi kim
Phản ứng với oxi:
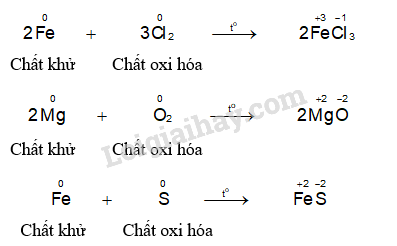
Sắt tác dụng với oxi ở nhiệt độ cao tạo thành oxit sắt từ (Fe3O4): 3Fe + 2O2 → Fe3O4. Đây là phản ứng oxi hóa khử, sắt bị oxi hóa từ số oxi hóa 0 lên +8/3, oxi bị khử từ số oxi hóa 0 xuống -2. Oxit sắt từ là một chất rắn màu đen, dễ bị nam châm hút. Phản ứng này là nguyên nhân chính gây ra sự gỉ sét của sắt.Phản ứng với clo:
Sắt tác dụng với clo ở nhiệt độ thường tạo thành sắt(III) clorua (FeCl3): 2Fe + 3Cl2 → 2FeCl3. Đây cũng là phản ứng oxi hóa khử, sắt bị oxi hóa từ số oxi hóa 0 lên +3, clo bị khử từ số oxi hóa 0 xuống -1. Sắt(III) clorua là chất rắn màu nâu đỏ, dễ tan trong nước.Phản ứng với lưu huỳnh:
Sắt tác dụng với lưu huỳnh khi đun nóng tạo thành sắt(II) sunfua (FeS): Fe + S → FeS. Đây là phản ứng hóa hợp, sắt và lưu huỳnh kết hợp với nhau tạo thành hợp chất mới. FeS là chất rắn màu đen.Phản ứng với axit
Phản ứng với axit HCl và H2SO4 loãng:
Sắt tác dụng với axit clohiđric (HCl) và axit sunfuric (H2SO4) loãng tạo thành muối sắt(II) tương ứng và giải phóng khí hiđro: Fe + 2HCl → FeCl2 + H2; Fe + H2SO4 → FeSO4 + H2. Đây là phản ứng thế, sắt đẩy hiđro ra khỏi axit.Phản ứng với dung dịch muối
Sắt có thể đẩy kim loại kém hoạt động hơn ra khỏi dung dịch muối của chúng. Ví dụ, sắt tác dụng với dung dịch đồng(II) sunfat tạo thành sắt(II) sunfat và đồng: Fe + CuSO4 → FeSO4 + Cu. Tóm lại, sắt là một kim loại có tính khử mạnh, dễ dàng tham gia vào các phản ứng hóa học, thể hiện tính chất hóa học đa dạng. Hiểu rõ các tính chất hóa học cơ bản của sắt giúp chúng ta ứng dụng sắt và hợp chất của nó vào nhiều lĩnh vực khác nhau của đời sống và sản xuất.Sản phẩm liên quan: anh kim đồng là ai
Sản phẩm hữu ích: nhôm oxit là gì
Xem thêm: cấu hình electron lớp ngoài cùng của kim loại kiềm thổ là