Tính chất hóa học cơ bản của các halogen
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
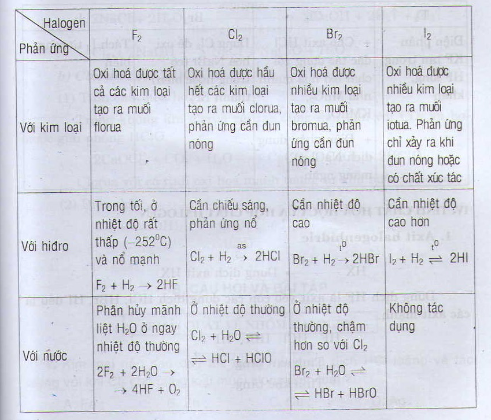
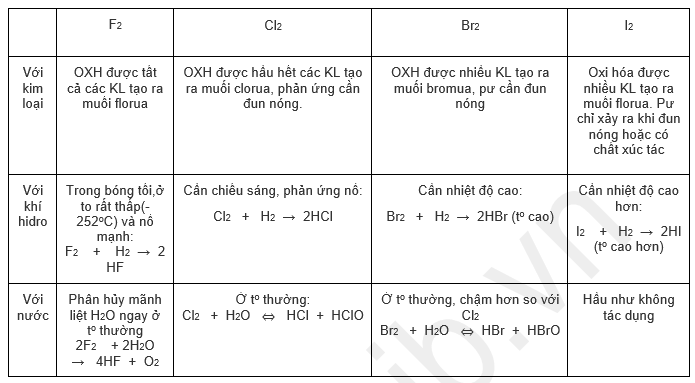
Tính chất hóa học cơ bản của các halogen thể hiện ở khả năng oxi hóa mạnh, giảm dần từ flo đến iot. Chúng dễ dàng tạo ra các hợp chất với nhiều nguyên tố khác, đặc biệt là các kim loại và phi kim. Dưới đây là chi tiết về các tính chất hóa học cơ bản của nhóm halogen:
Tính oxi hóa
Phản ứng với kim loại
Các halogen phản ứng với hầu hết các kim loại tạo thành muối halogenua. Phản ứng xảy ra mạnh nhất với flo, yếu dần theo thứ tự F2 > Cl2 > Br2 > I2. Ví dụ: 2Na + Cl2 → 2NaCl (Natri clorua). Độ mạnh của phản ứng phụ thuộc vào hoạt tính của kim loại và halogen.Phản ứng với hidro
Các halogen phản ứng với hidro tạo thành hidro halogenua: H2 + X2 → 2HX (X là F, Cl, Br, I). Phản ứng với flo xảy ra mãnh liệt ngay cả ở nhiệt độ thấp, trong khi phản ứng với iot cần điều kiện nhiệt độ và xúc tác.Phản ứng với phi kim khác
Các halogen cũng có thể phản ứng với một số phi kim khác, ví dụ như phản ứng của clo với photpho tạo thành photpho triclorua (PCl3) hoặc photpho pentaclorua (PCl5).Tính khử
Sự thay đổi tính khử theo dãy halogen
Mặc dù tính chất nổi bật của halogen là tính oxi hóa, nhưng khả năng thể hiện tính khử cũng tồn tại, đặc biệt là đối với các halogen có số oxi hóa thấp. Khả năng khử tăng dần từ flo đến iot. Flo hầu như không thể hiện tính khử, trong khi iot có thể bị oxi hóa bởi các chất oxi hóa mạnh hơn như axit nitric đậm đặc.Một số phản ứng đặc trưng khác
Phản ứng với nước
Flo phản ứng mạnh với nước tạo thành axit flohydric (HF) và oxi. Clo, brom và iot phản ứng chậm hơn, tạo ra hỗn hợp axit halogenhydric và axit hipohalogenơ.Phản ứng với dung dịch kiềm
Các halogen phản ứng với dung dịch kiềm tạo ra hỗn hợp muối halogenua và hipohalogenit (hoặc halat, perhalat tùy thuộc vào điều kiện phản ứng).Sản phẩm hữu ích: cảnh sắc mùa xuân vùng trung du
Xem thêm: bàn tay vuốt trụ là gì
Sản phẩm hữu ích: điện tích hạt nhân bằng
Sản phẩm hữu ích: kề bù là bao nhiêu độ