Tính chất của Axit Clohiđric
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Axit clohiđric (HCl) là một axit mạnh, ăn mòn, có nhiều tính chất hóa học đặc trưng. Bài viết này sẽ trình bày chi tiết về các tính chất vật lý và hóa học quan trọng của axit clohiđric.
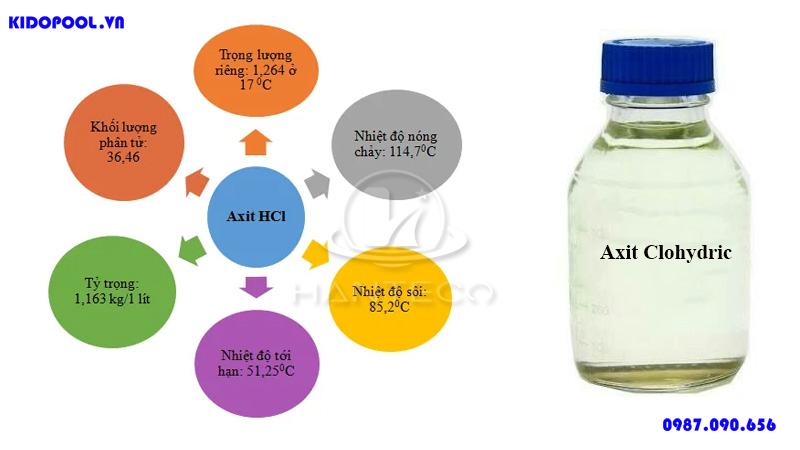
Tính chất vật lý của Axit Clohiđric
Trạng thái, màu sắc và mùi:
Axit clohiđric ở dạng dung dịch không màu, trong suốt, có mùi xốc, khó chịu. Khi có lẫn tạp chất như sắt thì dung dịch sẽ có màu vàng nhạt.Khả năng hòa tan:
HCl hòa tan tốt trong nước, tạo thành dung dịch axit mạnh.Tỷ trọng và nhiệt độ sôi, nhiệt độ nóng chảy:
Tỷ trọng, nhiệt độ sôi và nhiệt độ nóng chảy của axit clohiđric phụ thuộc vào nồng độ của dung dịch.Tính chất hóa học của Axit Clohiđric
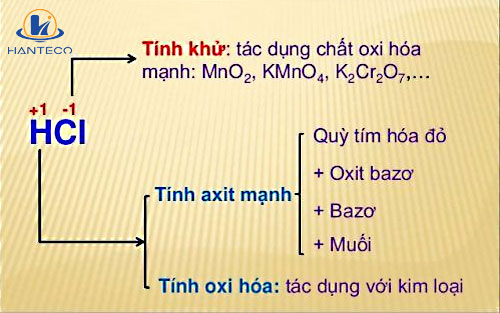
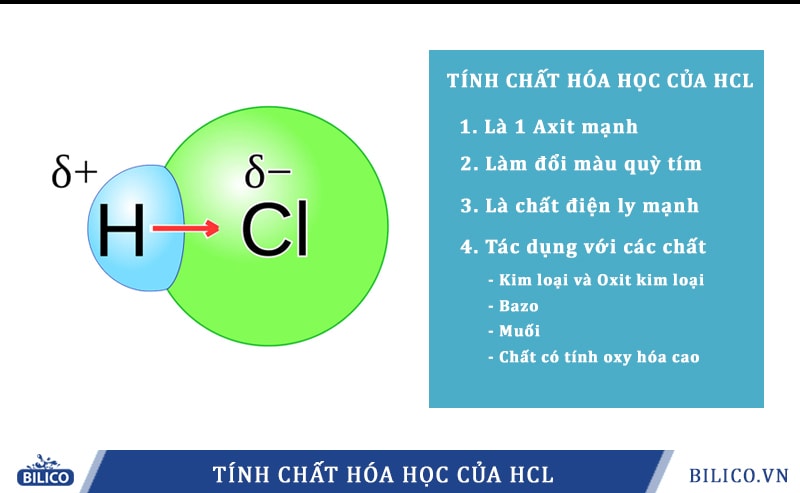
Tính axit mạnh:
HCl là một axit mạnh, phân ly hoàn toàn trong nước thành ion H+ và Cl-. Do đó, nó làm đổi màu chất chỉ thị như quỳ tím (chuyển sang màu đỏ) và phenolphtalein (không đổi màu).Phản ứng với kim loại:
HCl phản ứng với nhiều kim loại đứng trước hiđro trong dãy hoạt động hóa học (như Zn, Fe, Mg, Al...) tạo thành muối clorua và giải phóng khí hiđro. Ví dụ: Fe + 2HCl → FeCl2 + H2Phản ứng với oxit kim loại:
HCl phản ứng với nhiều oxit kim loại tạo thành muối clorua và nước. Ví dụ: CuO + 2HCl → CuCl2 + H2OPhản ứng với bazơ:
HCl phản ứng với bazơ tạo thành muối clorua và nước (phản ứng trung hòa). Ví dụ: NaOH + HCl → NaCl + H2OPhản ứng với muối:
HCl phản ứng với một số muối tạo thành muối mới và axit mới (điều kiện là axit mới yếu hơn HCl hoặc axit mới bay hơi). Ví dụ: Na2CO3 + 2HCl → 2NaCl + H2O + CO2Tính khử:
Ở điều kiện thích hợp, HCl có thể thể hiện tính khử, đặc biệt khi tác dụng với chất oxi hóa mạnh như KMnO4, MnO2…Sản phẩm hữu ích: v cut là gì
Xem thêm: giáo án nhận biết hình tròn
Xem thêm: tôm lóng là tôm gì
Sản phẩm hữu ích: bacl2 + mgso4 → ?
Xem thêm: quy ước chiều dòng điện