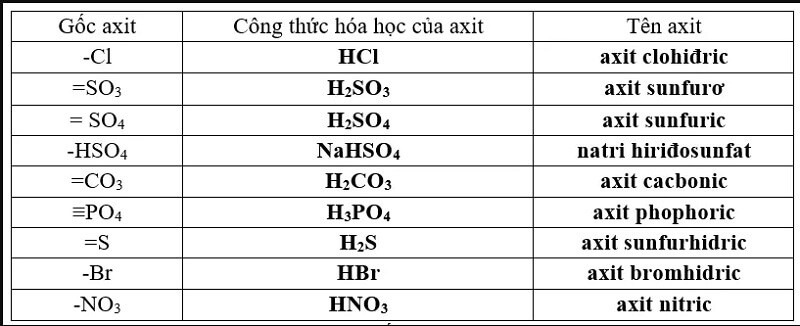
Thứ tự mạnh yếu của các axit

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Thứ tự mạnh yếu của các axit được xác định dựa trên độ mạnh của chúng trong việc phân ly thành ion H+ trong dung dịch nước. Axit mạnh phân ly hoàn toàn, trong khi axit yếu chỉ phân ly một phần. Dưới đây là thứ tự mạnh yếu của một số axit thường gặp, cần lưu ý rằng đây chỉ là một thứ tự tương đối và độ mạnh của axit có thể thay đổi tùy thuộc vào điều kiện môi trường.
Phân loại axit dựa trên độ mạnh
Axit mạnh:
Các axit mạnh phân ly hoàn toàn trong dung dịch nước, nghĩa là hầu hết các phân tử axit bị ion hóa thành ion H+ và anion. Ví dụ: HCl (axit clohydric), HBr (axit bromhydric), HI (axit iodhydric), HNO3 (axit nitric), H2SO4 (axit sulfuric - chỉ phân ly hoàn toàn bước 1), HClO4 (axit pecloric).Axit yếu:
Các axit yếu chỉ phân ly một phần trong dung dịch nước. Hầu hết các phân tử axit vẫn ở dạng phân tử chưa phân ly. Độ mạnh của axit yếu được thể hiện bằng hằng số phân ly axit (Ka). Axit có Ka càng lớn thì càng mạnh. Ví dụ: CH3COOH (axit axetic), H2CO3 (axit cacbonic), H3PO4 (axit photphoric), HF (axit flohydric).Thứ tự mạnh yếu tương đối của một số axit
Axit mạnh > Axit yếu. Tuy nhiên, để so sánh chính xác hơn, cần phải sử dụng giá trị Ka. Một cách sắp xếp theo thứ tự giảm dần độ mạnh (tương đối) có thể là: HClO4 > HI > HBr > HCl > H2SO4 > HNO3 > H3O+ > HSO4- > H3PO4 > HF > CH3COOH > H2CO3 > H2S > HCN. Lưu ý rằng thứ tự này không phải là tuyệt đối và có thể thay đổi tùy thuộc vào dung môi và các điều kiện khác. Việc xác định chính xác độ mạnh của axit cần dựa vào các dữ liệu thực nghiệm và các thông số như hằng số phân ly axit (Ka) hoặc pH.Xem thêm: photpho kí hiệu là gì
Xem thêm: h2s so2 s h2o
Sản phẩm liên quan: họ tắc kè hoa