Sự Phân Bố Electron
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Sự phân bố electron trong nguyên tử được xác định bởi các nguyên lý và quy tắc lượng tử, mô tả cách các electron sắp xếp vào các lớp năng lượng và phân lớp khác nhau. Nó quyết định tính chất hóa học và vật lý của nguyên tố.
Nguyên lý Aufbau và Quy tắc Hund
Nguyên lý Aufbau:
Các electron điền vào các obitan có năng lượng thấp nhất trước khi điền vào các obitan có năng lượng cao hơn. Thứ tự điền electron được mô tả bằng sơ đồ Aufbau.Quy tắc Hund:
Trong cùng một phân lớp, các electron sẽ điền vào các obitan riêng lẻ trước khi bắt đầu ghép đôi trong cùng một obitan. Điều này tối đa hóa mômen từ của nguyên tử.Cấu hình electron
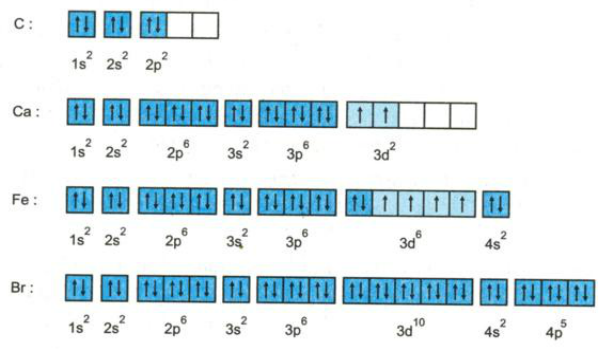
Cấu hình electron là cách biểu diễn sự phân bố electron trong nguyên tử. Nó thể hiện số lượng electron trong mỗi lớp và phân lớp. Ví dụ, cấu hình electron của nguyên tử Natri (Na) là 1s22s22p63s1. Điều này cho thấy Natri có 11 electron được phân bố vào các lớp K, L và M.
Lớp electron và phân lớp
Lớp electron:
Các lớp electron được đánh số từ 1 đến 7 (tương ứng với các lớp K, L, M, N, O, P, Q), với lớp 1 là lớp gần hạt nhân nhất và có năng lượng thấp nhất. Số lượng electron tối đa trong mỗi lớp được tính theo công thức 2n2, với n là số thứ tự của lớp.Phân lớp electron:
Mỗi lớp electron lại chia thành các phân lớp: s, p, d, f. Mỗi phân lớp có một số lượng obitan nhất định, và mỗi obitan có thể chứa tối đa 2 electron.Ảnh hưởng của sự phân bố electron đến tính chất hóa học
Sự phân bố electron, đặc biệt là electron hóa trị (electron ở lớp ngoài cùng), quyết định khả năng tham gia phản ứng hóa học của nguyên tố. Nguyên tố có electron hóa trị ít thường có xu hướng nhường electron để đạt được cấu hình electron bền vững (giống như khí hiếm), trong khi nguyên tố có electron hóa trị nhiều thường có xu hướng nhận electron. Sự phân bố electron cũng ảnh hưởng đến các tính chất vật lý như độ dẫn điện, độ dẫn nhiệt, tính từ tính, v.v.Xem thêm: điểm chuẩn đại học kinh tế kỹ thuật công nghiệp 2023
Xem thêm: con lắc lò xo công thức
Sản phẩm liên quan: mạch điện song song