SO2 có điện li không?


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
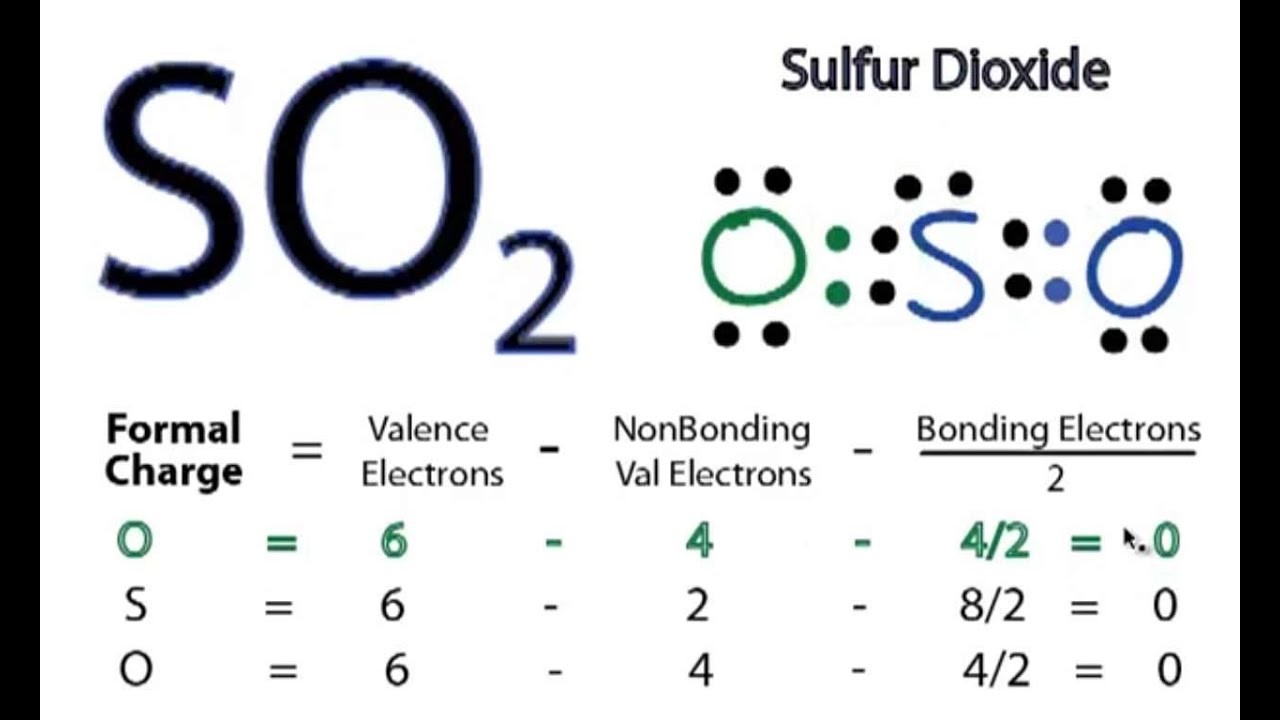
SO2 (lưu huỳnh đioxit) là một oxit axit, nhưng nó không điện li mạnh trong nước. Câu trả lời ngắn gọn là: **SO2 điện li yếu.**
Điện li của SO2
Cơ chế điện li
SO2 khi hòa tan trong nước tạo thành dung dịch axit sunfurơ (H2SO3) theo phản ứng: SO2 + H2O ⇌ H2SO3. Axit sunfurơ là một axit yếu, do đó nó chỉ phân li một phần thành ion H+ và ion HSO3−. Phản ứng điện li diễn ra như sau: H2SO3 ⇌ H+ + HSO3−. Một phần nhỏ ion HSO3− tiếp tục phân li: HSO3− ⇌ H+ + SO32−. Như vậy, quá trình điện li của SO2 trong nước là một quá trình cân bằng, không hoàn toàn.Độ mạnh điện li
Do chỉ điện li yếu, nồng độ ion H+ trong dung dịch SO2 tương đối thấp so với các axit mạnh như HCl hay H2SO4. Điều này giải thích tại sao dung dịch SO2 có độ dẫn điện thấp hơn so với các dung dịch axit mạnh.Ứng dụng thực tiễn
Tính chất điện li yếu của SO2 có nhiều ứng dụng thực tiễn, ví dụ trong công nghiệp thực phẩm (làm chất bảo quản), công nghiệp giấy và trong một số phản ứng hóa học. Hiểu rõ về độ mạnh điện li của SO2 giúp chúng ta kiểm soát và ứng dụng hiệu quả trong các lĩnh vực này.Sản phẩm hữu ích: so2 + naoh ra nahso3
Sản phẩm liên quan: nghĩa của từ hạnh phúc
Sản phẩm liên quan: ba quan mời trầu lời