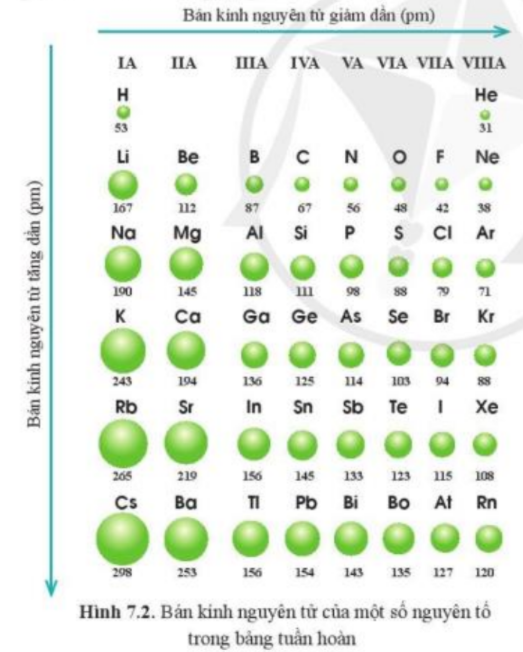
So sánh bán kính ion


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Bán kính ion là khoảng cách từ hạt nhân đến lớp electron ngoài cùng của một ion. So sánh bán kính ion giúp chúng ta hiểu rõ hơn về tính chất hóa học và vật lý của các nguyên tố và hợp chất. Sự khác biệt về bán kính ion phụ thuộc vào nhiều yếu tố, bao gồm điện tích hạt nhân, số electron và hiệu ứng chắn.
Yếu tố ảnh hưởng đến bán kính ion
Điện tích hạt nhân:
Điện tích hạt nhân càng lớn, lực hút giữa hạt nhân và electron càng mạnh, dẫn đến bán kính ion càng nhỏ. Ví dụ, ion Na+ có bán kính nhỏ hơn nguyên tử Na do mất đi một electron lớp ngoài cùng.Số lớp electron:
Số lớp electron càng nhiều, bán kính ion càng lớn. Ví dụ, ion I- có bán kính lớn hơn ion F- vì I- có nhiều lớp electron hơn.Hiệu ứng chắn:
Electron ở các lớp trong cùng có thể chắn bớt lực hút của hạt nhân lên electron ở các lớp ngoài cùng. Hiệu ứng chắn càng lớn, lực hút của hạt nhân lên electron ngoài cùng càng yếu, dẫn đến bán kính ion càng lớn.Xu hướng bán kính ion trong bảng tuần hoàn
Trong cùng một chu kì:
Bán kính ion giảm dần khi đi từ trái sang phải. Điều này là do điện tích hạt nhân tăng dần mà số lớp electron không đổi, dẫn đến lực hút giữa hạt nhân và electron tăng lên.Trong cùng một nhóm:
Bán kính ion tăng dần khi đi từ trên xuống dưới. Điều này là do số lớp electron tăng dần, làm tăng khoảng cách giữa hạt nhân và electron ngoài cùng.Ví dụ so sánh bán kính ion
Hãy so sánh bán kính ion của Li+, Na+ và K+. Cả ba ion này đều thuộc nhóm IA. Do số lớp electron tăng dần từ Li+ đến K+, bán kính ion tăng dần theo thứ tự: Li+ < Na+ < K+.Ứng dụng của so sánh bán kính ion
So sánh bán kính ion có nhiều ứng dụng quan trọng trong hóa học, chẳng hạn như: * Dự đoán tính chất vật lý của các hợp chất ion. * Giải thích sự biến đổi tính chất hóa học của các nguyên tố trong bảng tuần hoàn. * Thiết kế và tổng hợp các vật liệu mới.Sản phẩm hữu ích: sau are là từ loại gì
Sản phẩm liên quan: tk 155 theo thông tư 200
Xem thêm: anh thích em như thế
Xem thêm: cách đọc số 5
Xem thêm: 6 chữ vàng trần quốc toản