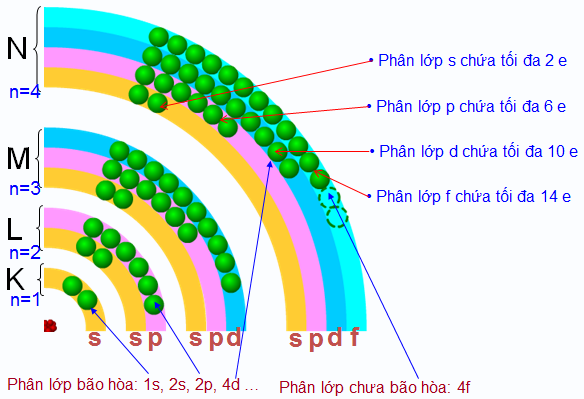
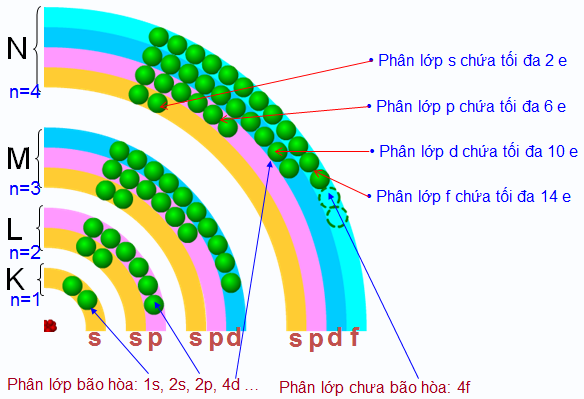
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là bao nhiêu?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là 2, 6, 10, 14.
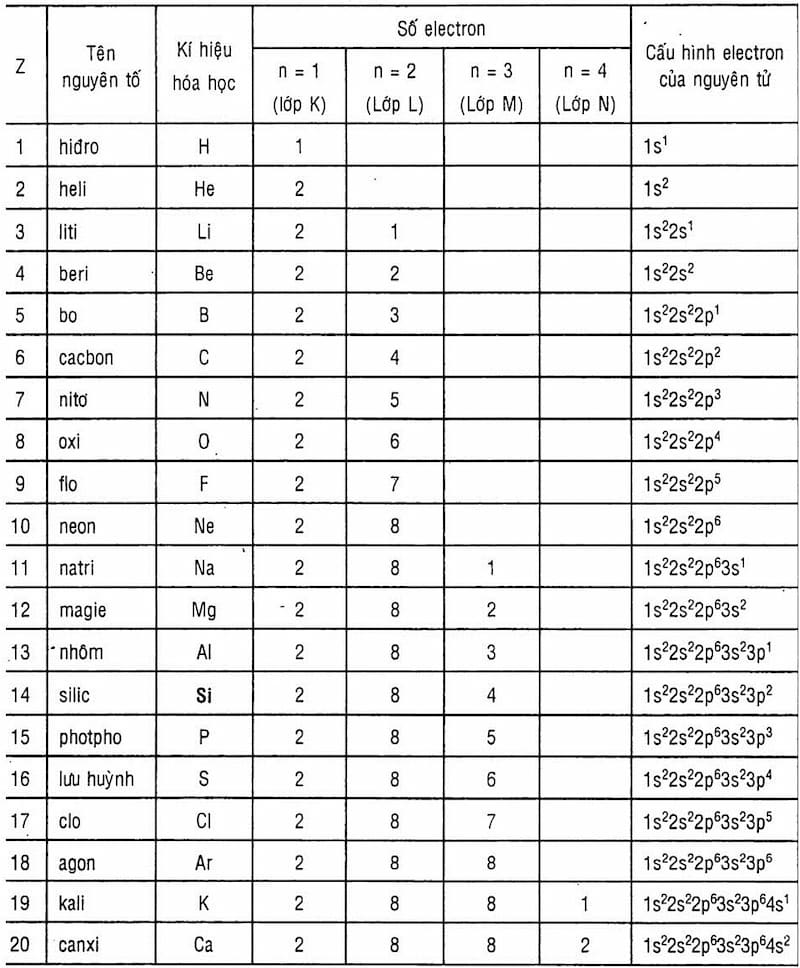
Cấu hình electron và phân lớp nguyên tử
Phân lớp s:
Phân lớp s là phân lớp có năng lượng thấp nhất trong một lớp electron. Nó chỉ chứa tối đa 2 electron, với số lượng electron tối đa được xác định bởi công thức 2n2, trong đó n là số lượng lớp electron. Ví dụ, lớp electron đầu tiên (n=1) chỉ có phân lớp 1s, chứa tối đa 2 electron.Phân lớp p:
Phân lớp p có năng lượng cao hơn phân lớp s trong cùng một lớp electron. Nó có thể chứa tối đa 6 electron. Cụ thể, nó gồm 3 obitan nguyên tử, mỗi obitan chứa tối đa 2 electron (theo nguyên lý Pauli).Phân lớp d:
Phân lớp d có năng lượng cao hơn phân lớp p và có thể chứa tối đa 10 electron. Nó gồm 5 obitan nguyên tử, mỗi obitan chứa tối đa 2 electron.Phân lớp f:
Phân lớp f là phân lớp có năng lượng cao nhất trong bốn phân lớp chính (s, p, d, f). Nó có thể chứa tối đa 14 electron, với 7 obitan nguyên tử, mỗi obitan chứa tối đa 2 electron. Các nguyên tố có electron ở phân lớp f thường là các nguyên tố đất hiếm.Tổng kết lại, số electron tối đa trong các phân lớp s, p, d, f lần lượt là 2, 6, 10 và 14. Việc hiểu rõ về số electron tối đa trong mỗi phân lớp là rất quan trọng để viết được cấu hình electron chính xác cho các nguyên tử và ion.
Xem thêm: muối tác dụng với axit
Sản phẩm hữu ích: thế năng con lắc đơn
Sản phẩm liên quan: đơn vị tính lít
Xem thêm: cách ươm dâu tây