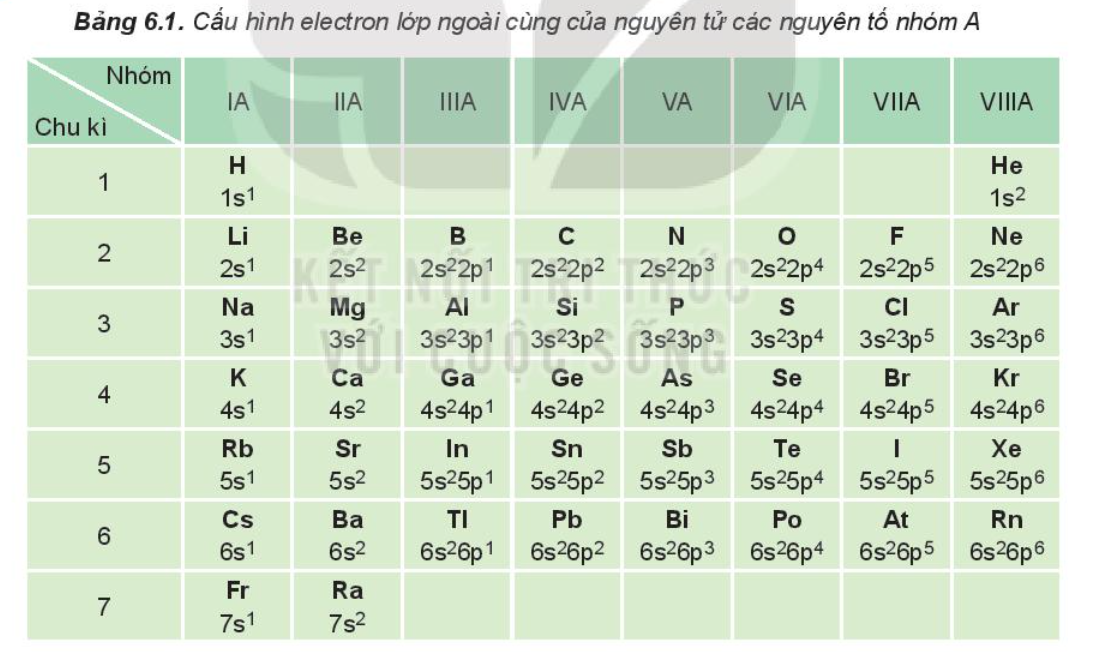
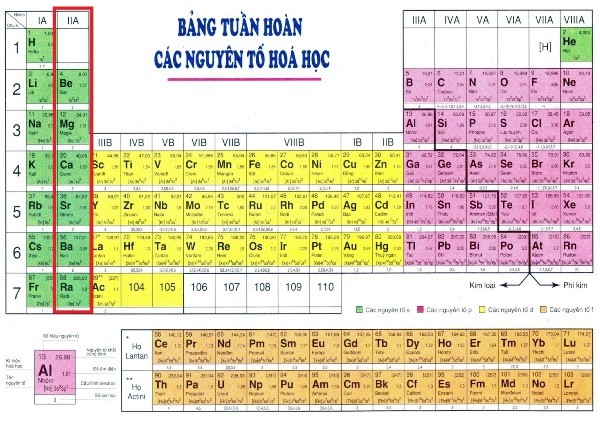
Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là bao nhiêu?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Số electron lớp ngoài cùng của các nguyên tử kim loại thuộc nhóm IIA là 2.
Nhóm IIA: Kim loại kiềm thổ
Đặc điểm cấu hình electron
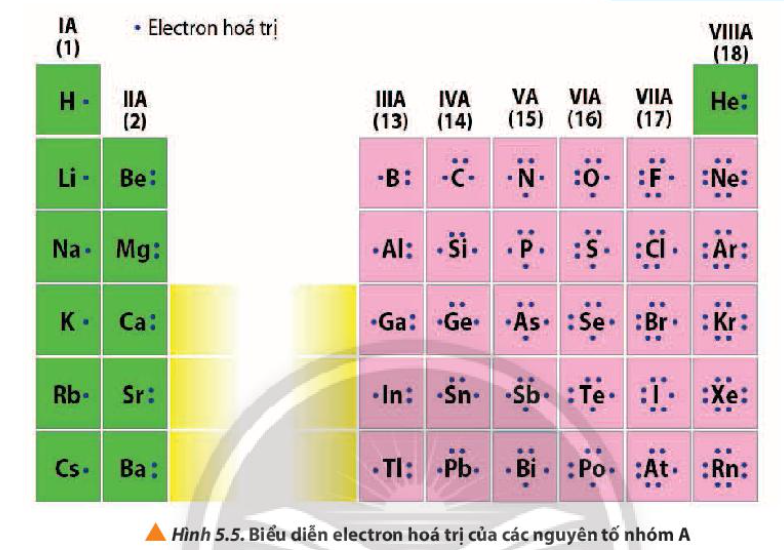
Các nguyên tố thuộc nhóm IIA, còn được gọi là kim loại kiềm thổ, đều có cấu hình electron lớp ngoài cùng là ns2 (với n là số lớp electron). Điều này có nghĩa là chúng có 2 electron ở lớp electron ngoài cùng. Chính 2 electron này quyết định nhiều tính chất hóa học đặc trưng của nhóm IIA. Ví dụ: Berili (Be) có cấu hình electron 1s22s2, Magie (Mg) có cấu hình electron 1s22s22p63s2, Canxi (Ca) có cấu hình electron 1s22s22p63s23p64s2, và vân vân. Như vậy, tất cả đều có 2 electron ở lớp ngoài cùng.Tính chất hóa học
Việc có 2 electron lớp ngoài cùng khiến các kim loại kiềm thổ có xu hướng dễ dàng mất 2 electron này để đạt được cấu hình electron bền vững của khí hiếm. Do đó, chúng thể hiện tính khử mạnh và tạo ra các ion có điện tích 2+ (M2+). Tính khử này tăng dần từ trên xuống dưới trong nhóm do bán kính nguyên tử tăng và năng lượng ion hóa giảm. Tính chất này được thể hiện rõ trong phản ứng của chúng với nước, oxi và các phi kim khác.Ứng dụng
Các kim loại nhóm IIA có nhiều ứng dụng quan trọng trong công nghiệp và đời sống, ví dụ như: Magie được sử dụng trong sản xuất hợp kim nhẹ, Canxi được dùng trong sản xuất vôi, stronti được sử dụng trong pháo hoa, bari được sử dụng trong các thiết bị điện tử... Ứng dụng cụ thể của từng nguyên tố phụ thuộc vào tính chất riêng biệt của chúng, nhưng đều bắt nguồn từ cấu hình electron đặc trưng ns2.Sản phẩm liên quan: số oxi hóa của ch3cho
Sản phẩm liên quan: từ đồng nghĩa với phát triển
Sản phẩm liên quan: láy âm là gì