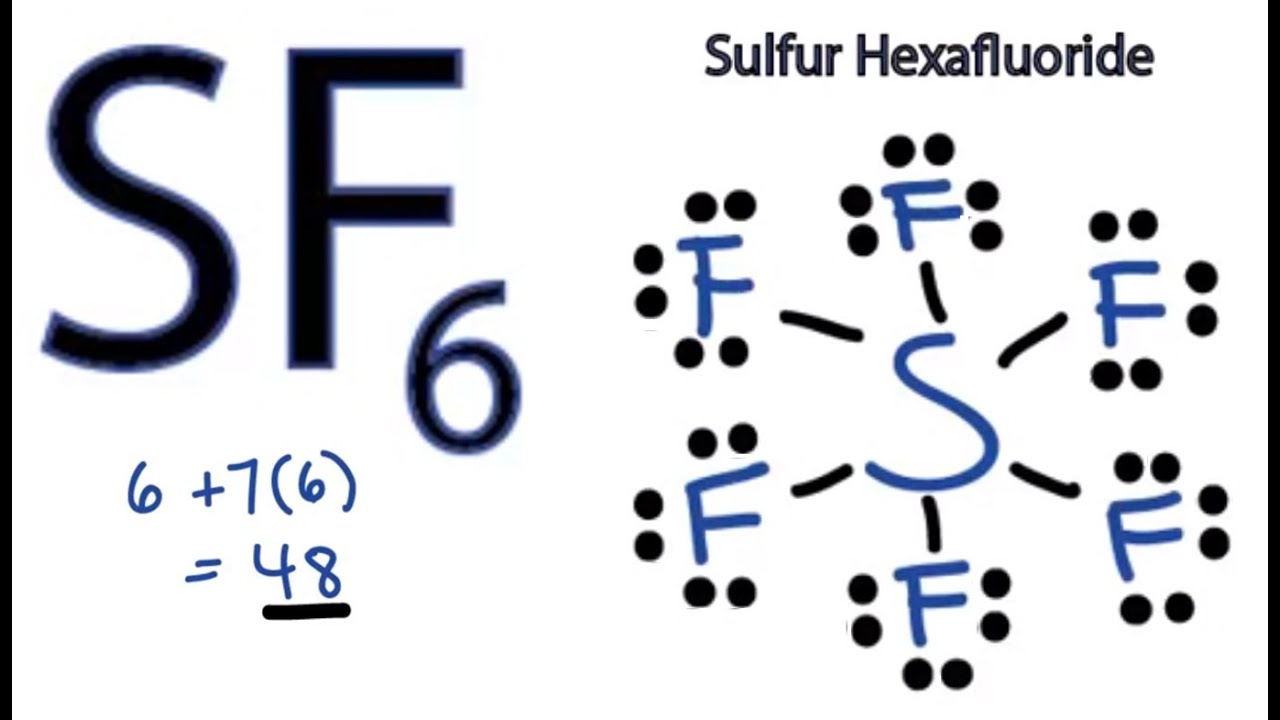
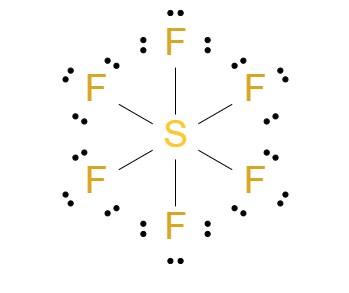
SF6 Estructura de Lewis

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
La estructura de Lewis del hexafluoruro de azufre (SF6) muestra un átomo de azufre central rodeado por seis átomos de flúor, cada uno unido al azufre mediante un enlace sencillo. Cada átomo de flúor contribuye con un electrón al enlace, mientras que el azufre aporta seis electrones de valencia. Esto resulta en una estructura octaédrica con todos los átomos de flúor en los vértices de un octaedro regular.
Geometría Molecular y Enlaces
Geometría Octaédrica
La geometría molecular del SF6 es octaédrica. Esto significa que los seis átomos de flúor se disponen simétricamente alrededor del átomo de azufre, formando ocho caras triangulares. Esta geometría es una consecuencia de la repulsión entre los pares de electrones de valencia y es la configuración más estable para minimizar la repulsión.
Enlaces Simples
Cada enlace entre el azufre y un átomo de flúor es un enlace simple covalente, formado por la compartición de un par de electrones entre los dos átomos. La diferencia de electronegatividad entre el azufre y el flúor es significativa, lo que lleva a un enlace ligeramente polar, aunque la geometría simétrica de la molécula hace que el momento dipolar total sea cero.
Hibridación del Azufre
Hibridación sp³d²
Para acomodar seis átomos de flúor alrededor del átomo central de azufre, se necesita una hibridación sp³d². Esto implica la combinación de un orbital s, tres orbitales p, y dos orbitales d del azufre para formar seis orbitales híbridos sp³d², cada uno de los cuales se superpone con un orbital p de un átomo de flúor para formar un enlace sigma.
Conclusión
En resumen, la estructura de Lewis del SF6 muestra una geometría molecular octaédrica con seis enlaces simples entre el átomo de azufre central y seis átomos de flúor. La hibridación sp³d² del átomo de azufre explica la formación de estos seis enlaces.
Sản phẩm hữu ích: nahco3 + ba(oh)2 dư
Sản phẩm hữu ích: h3po4 la axit mấy nấc
Sản phẩm liên quan: 18 đôi mươi lời
Sản phẩm liên quan: 1 chỉ rưỡi vàng bao nhiêu tiền