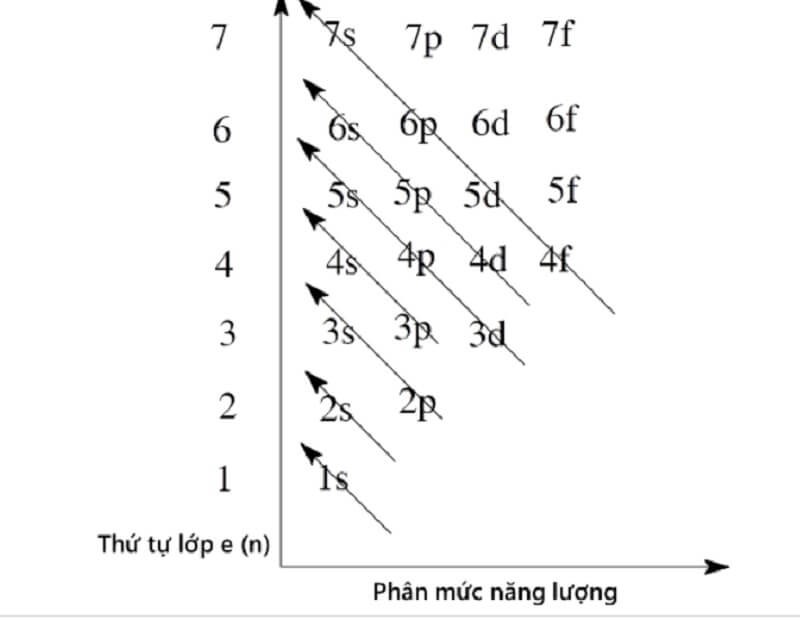
Sắp xếp các phân lớp theo thứ tự mức năng lượng tăng dần
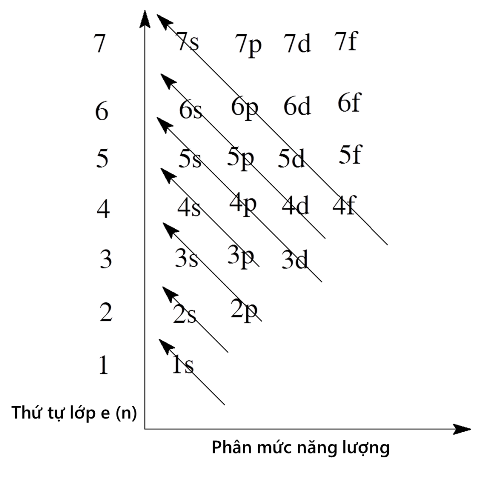
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Thứ tự mức năng lượng tăng dần của các phân lớp electron trong nguyên tử là: 1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s < 5f < 6d < 7p…
Nguyên tắc sắp xếp phân lớp theo mức năng lượng
Quy tắc Hund
Quy tắc Hund nêu rằng các electron sẽ điền vào các obitan trong cùng một phân lớp với spin song song trước khi bắt đầu điền vào obitan khác với spin ngược chiều. Điều này giúp tối thiểu hóa năng lượng của hệ thống.
Nguyên lý Pauli
Nguyên lý Pauli khẳng định không có hai electron nào trong cùng một nguyên tử có thể có cùng bốn số lượng tử. Điều này có nghĩa là mỗi obitan chỉ có thể chứa tối đa hai electron với spin ngược nhau.
Nguyên lý Aufbau
Nguyên lý Aufbau chỉ ra rằng các electron được điền vào các obitan nguyên tử theo thứ tự năng lượng tăng dần. Thứ tự này được thể hiện trong biểu đồ năng lượng phân lớp, như được trình bày ở trên.
Áp dụng vào ví dụ cụ thể
Ví dụ: Nguyên tử Cacbon (C)
Cacbon có 6 electron. Theo nguyên lý Aufbau và quy tắc Hund, thứ tự điền electron vào các phân lớp sẽ là: 1s22s22p2. Như vậy, ta thấy các electron được điền vào các phân lớp theo thứ tự năng lượng tăng dần: 1s, 2s, và 2p.
Kết luận
Việc hiểu rõ thứ tự mức năng lượng của các phân lớp electron là rất quan trọng để dự đoán cấu hình electron của nguyên tử và hiểu tính chất hóa học của chúng. Thứ tự này tuân theo các nguyên tắc cơ bản của cơ học lượng tử, bao gồm nguyên lý Aufbau, nguyên lý Pauli và quy tắc Hund.
Xem thêm: electronic configuration of zn + 2
Xem thêm: trong công nghiệp etilen được điều chế bằng cách
Xem thêm: glixerol + cuoh2 màu gì