Phản ứng oxi hóa là gì?
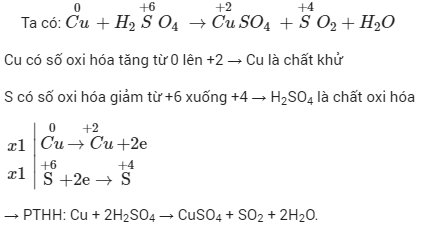
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng oxi hóa là quá trình một chất mất electron hoặc tăng số oxi hóa. Đây là một trong những phản ứng hóa học cơ bản và quan trọng, đóng vai trò then chốt trong nhiều lĩnh vực của cuộc sống.
Các khái niệm cơ bản về phản ứng oxi hóa
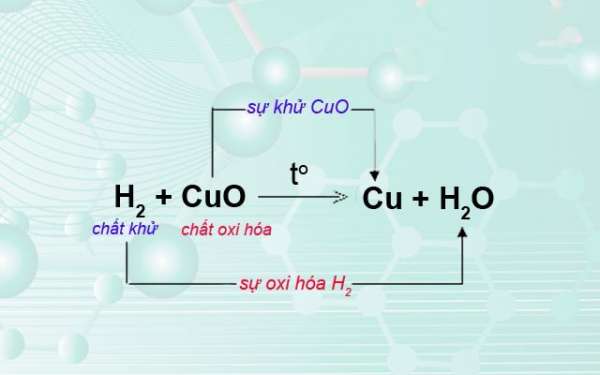
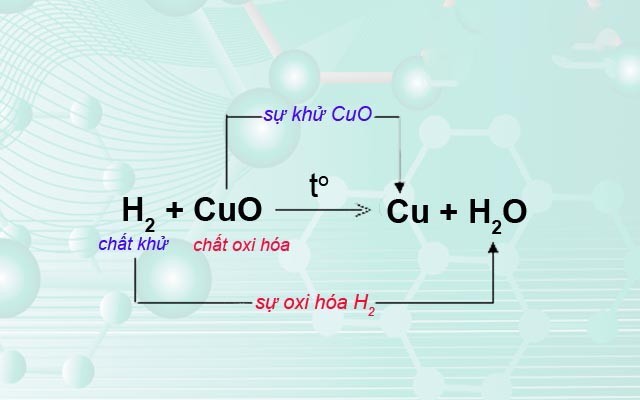
Sự oxi hóa và sự khử
Phản ứng oxi hóa luôn đi kèm với phản ứng khử. Sự khử là quá trình một chất nhận electron hoặc giảm số oxi hóa. Hai quá trình này cùng xảy ra trong một phản ứng gọi là phản ứng oxi hóa-khử (phản ứng redox).
Số oxi hóa
Số oxi hóa là một số chỉ thị điện tích của một nguyên tử trong một phân tử hoặc ion, giả sử rằng tất cả các liên kết là liên kết ion. Sự thay đổi số oxi hóa cho thấy sự mất hoặc thu nhận electron trong phản ứng oxi hóa-khử.
Chất oxi hóa và chất khử
Chất oxi hóa là chất nhận electron, gây ra sự oxi hóa chất khác. Chất khử là chất cho electron, gây ra sự khử chất khác. Trong một phản ứng oxi hóa-khử, chất oxi hóa bị khử và chất khử bị oxi hóa.
Ví dụ về phản ứng oxi hóa
Oxi hóa kim loại
Sự gỉ sét của sắt là một ví dụ điển hình về phản ứng oxi hóa. Sắt phản ứng với oxy trong không khí tạo thành sắt oxit (gỉ sắt): 4Fe + 3O2 → 2Fe2O3. Trong phản ứng này, sắt bị oxi hóa (mất electron) và oxy bị khử (nhận electron).
Oxi hóa nhiên liệu
Sự cháy của nhiên liệu như than, khí đốt, hay xăng dầu là một phản ứng oxi hóa. Ví dụ, sự cháy của methane: CH4 + 2O2 → CO2 + 2H2O. Trong phản ứng này, methane bị oxi hóa và oxy bị khử.
Phản ứng trong pin
Pin hoạt động dựa trên phản ứng oxi hóa-khử. Electron được chuyển từ cực âm (anốt) sang cực dương (catốt) qua mạch ngoài, tạo ra dòng điện. Sự oxi hóa xảy ra ở anốt và sự khử xảy ra ở catốt.
Ứng dụng của phản ứng oxi hóa
Phản ứng oxi hóa có ứng dụng rộng rãi trong nhiều lĩnh vực, bao gồm: sản xuất năng lượng (cháy), công nghiệp luyện kim (tách kim loại từ quặng), xử lý nước thải, bảo quản thực phẩm, và nhiều quá trình sinh học quan trọng khác.
Xem thêm: tóm tắt toán lớp 5
Xem thêm: kim loại không phản ứng với h2so4 loãng
Sản phẩm hữu ích: mẹo học dãy điện hóa
Sản phẩm liên quan: tat ca hoac khong la gi ca
Sản phẩm liên quan: download đề thi tiếng việt cho người nước ngoài