Phân lớp electron là gì?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
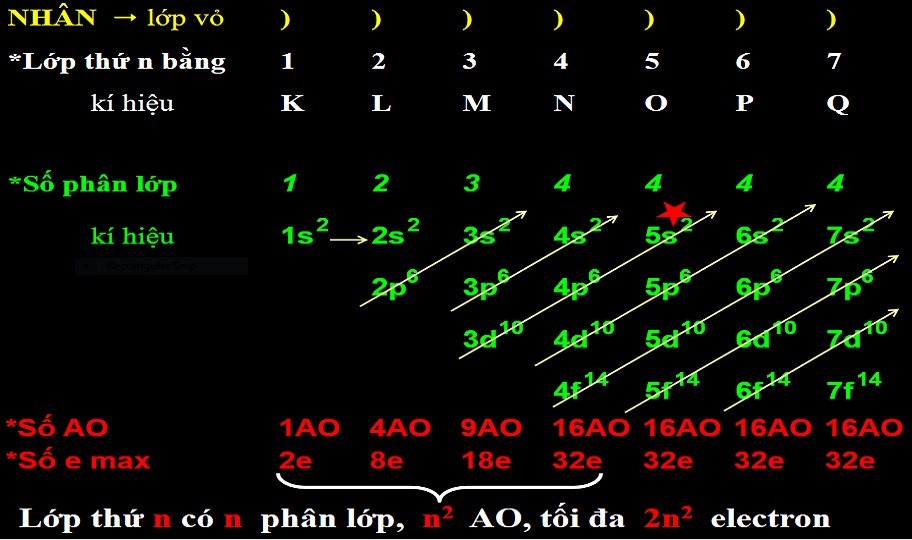
Phân lớp electron là một tập hợp các orbital nguyên tử có cùng mức năng lượng, thuộc cùng một lớp electron nhưng khác nhau về hình dạng. Nói một cách đơn giản, nó là sự phân chia nhỏ hơn bên trong lớp electron. Mỗi lớp electron lại được chia thành các phân lớp, được ký hiệu bằng các chữ cái s, p, d, f... Chúng khác nhau về số lượng orbital và hình dạng không gian của orbital.
Các loại phân lớp electron
Phân lớp s
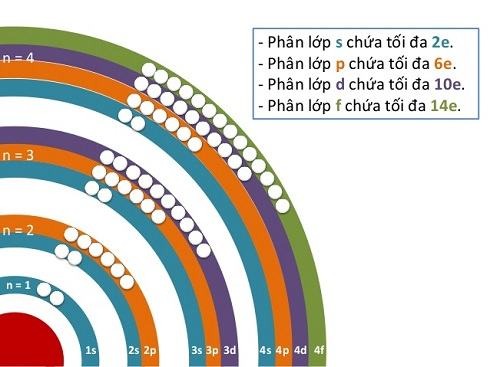
Phân lớp s chỉ có một orbital hình cầu, chứa tối đa 2 electron. Năng lượng của phân lớp s luôn thấp nhất trong cùng một lớp.
Phân lớp p
Phân lớp p có ba orbital hình tạ, mỗi orbital chứa tối đa 2 electron, vì vậy phân lớp p chứa tối đa 6 electron. Ba orbital này định hướng theo ba trục tọa độ x, y, z.
Phân lớp d
Phân lớp d có năm orbital, mỗi orbital chứa tối đa 2 electron, vì vậy phân lớp d chứa tối đa 10 electron. Hình dạng của các orbital d phức tạp hơn so với s và p.
Phân lớp f
Phân lớp f có bảy orbital, mỗi orbital chứa tối đa 2 electron, vì vậy phân lớp f chứa tối đa 14 electron. Hình dạng của các orbital f rất phức tạp.
Cách xác định phân lớp electron
Phân lớp electron được xác định bởi số lượng tử chính (n) và số lượng tử azimut (l). Số lượng tử chính (n) xác định lớp electron (n = 1, 2, 3,...), trong khi số lượng tử azimut (l) xác định phân lớp electron (l = 0 cho s, l = 1 cho p, l = 2 cho d, l = 3 cho f). Ví dụ, phân lớp 2p có n = 2 và l = 1.
Ứng dụng của khái niệm phân lớp electron
Hiểu về phân lớp electron rất quan trọng trong việc:
- Viết cấu hình electron của nguyên tử.
- Dự đoán tính chất hóa học của nguyên tố.
- Hiểu về liên kết hóa học.
- Giải thích các hiện tượng vật lý và hóa học.
Sản phẩm hữu ích: anh con trai rất tự nhiên
Xem thêm: muốn tính trung bình cộng ta làm như thế nào
Xem thêm: cá buồm dạ quang
Xem thêm: cach nau thit dong
Sản phẩm hữu ích: cây móng bò rừng