Oxi hóa là chất gì?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Oxi hóa không phải là một chất mà là một quá trình hóa học. Nó là sự phản ứng của một chất với oxy, hoặc sự mất đi electron của một nguyên tử, ion hay phân tử. Quá trình này thường sinh ra nhiệt và đôi khi tạo ra ánh sáng.
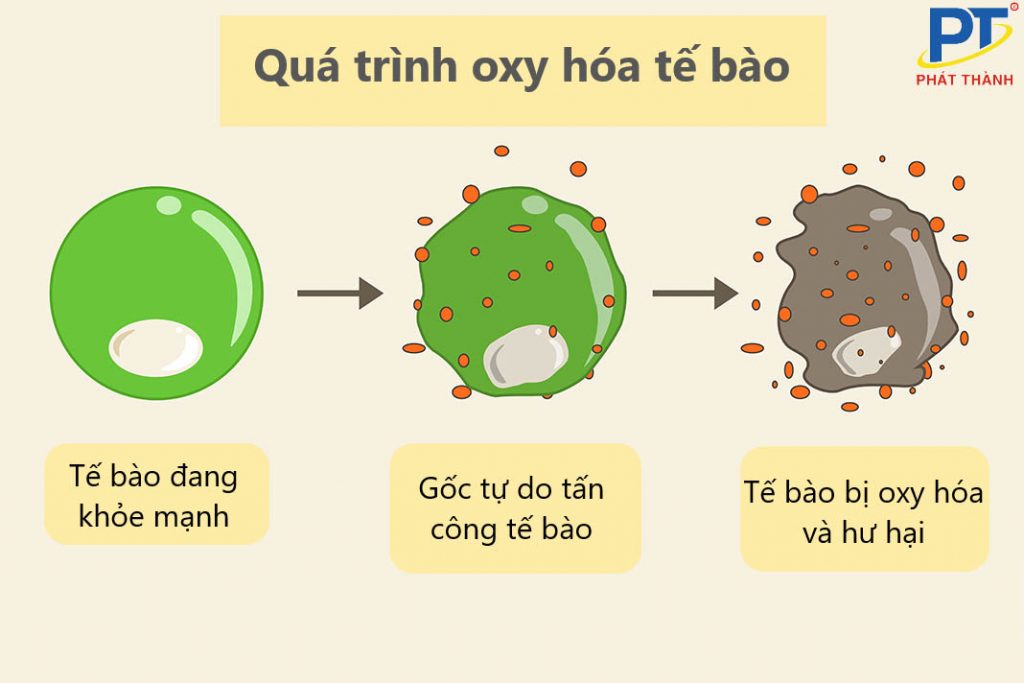
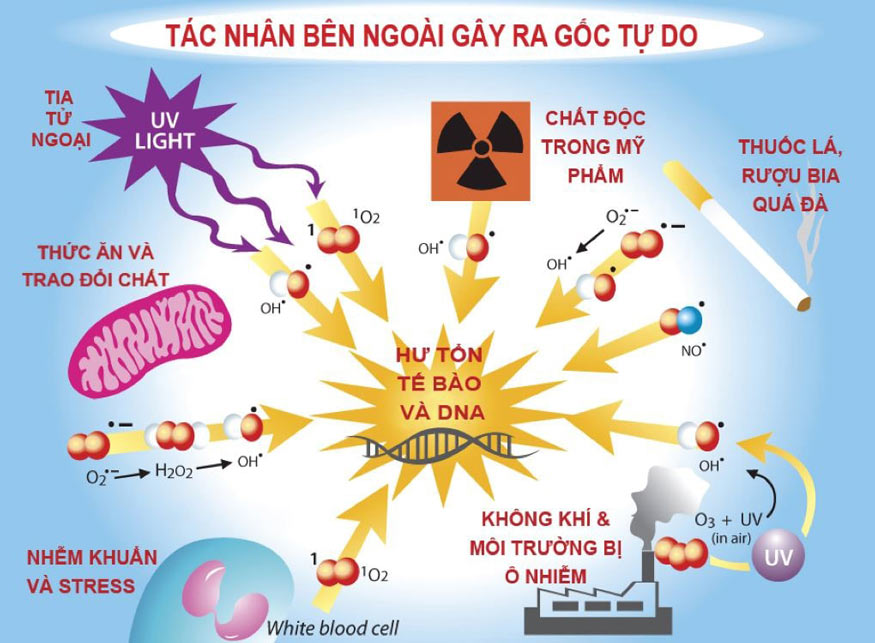
Các khía cạnh của quá trình oxi hóa
Oxi hóa và sự tham gia của oxy
Trong nhiều trường hợp, oxi hóa liên quan đến sự kết hợp trực tiếp của một chất với oxy. Ví dụ điển hình là sự gỉ sét của sắt, nơi sắt phản ứng với oxy trong không khí tạo thành oxit sắt (gỉ). Tuy nhiên, cần lưu ý rằng oxi hóa không chỉ giới hạn ở phản ứng với oxy.Oxi hóa và sự mất electron
Một định nghĩa chính xác hơn về oxi hóa là sự mất electron của một nguyên tử, ion hoặc phân tử. Trong quá trình này, chất bị oxi hóa sẽ có số oxi hóa tăng lên. Đây là một khía cạnh quan trọng của oxi hóa, đặc biệt trong hóa học điện cực và phản ứng oxi hóa khử.Ví dụ về phản ứng oxi hóa
Sự cháy của nhiên liệu (như gỗ, khí đốt) là một ví dụ điển hình về phản ứng oxi hóa nhanh, giải phóng một lượng lớn nhiệt và ánh sáng. Sự thối rữa của thực phẩm cũng là một quá trình oxi hóa chậm hơn, diễn ra trong thời gian dài hơn. Sự oxi hóa kim loại tạo thành gỉ sét là một ví dụ khác về quá trình oxi hóa chậm.Sự khác biệt giữa oxi hóa và sự cháy
Mặc dù nhiều phản ứng oxi hóa liên quan đến sự cháy, nhưng không phải tất cả các phản ứng oxi hóa đều là sự cháy. Sự cháy là một dạng oxi hóa nhanh, kèm theo sự giải phóng nhiệt và ánh sáng mạnh. Trong khi đó, oxi hóa có thể diễn ra chậm hơn, không tạo ra ánh sáng hoặc nhiệt đáng kể.Ứng dụng của oxi hóa
Oxi hóa được sử dụng rộng rãi trong nhiều lĩnh vực, bao gồm sản xuất năng lượng (cháy), bảo quản thực phẩm (làm khô, đóng hộp), và công nghiệp hóa chất (tổng hợp nhiều hợp chất). Tuy nhiên, trong một số trường hợp, oxi hóa có thể gây ra sự hư hỏng, ví dụ như sự gỉ sét của kim loại.Xem thêm: tác dụng dòng điện
Sản phẩm hữu ích: rất thích rất thích em pdf
Xem thêm: kim loại nào mạnh nhất
Xem thêm: bê con không chịu bú
Sản phẩm hữu ích: kính phân cực là gì