Phản ứng giữa Na2S2O3 và H2SO4
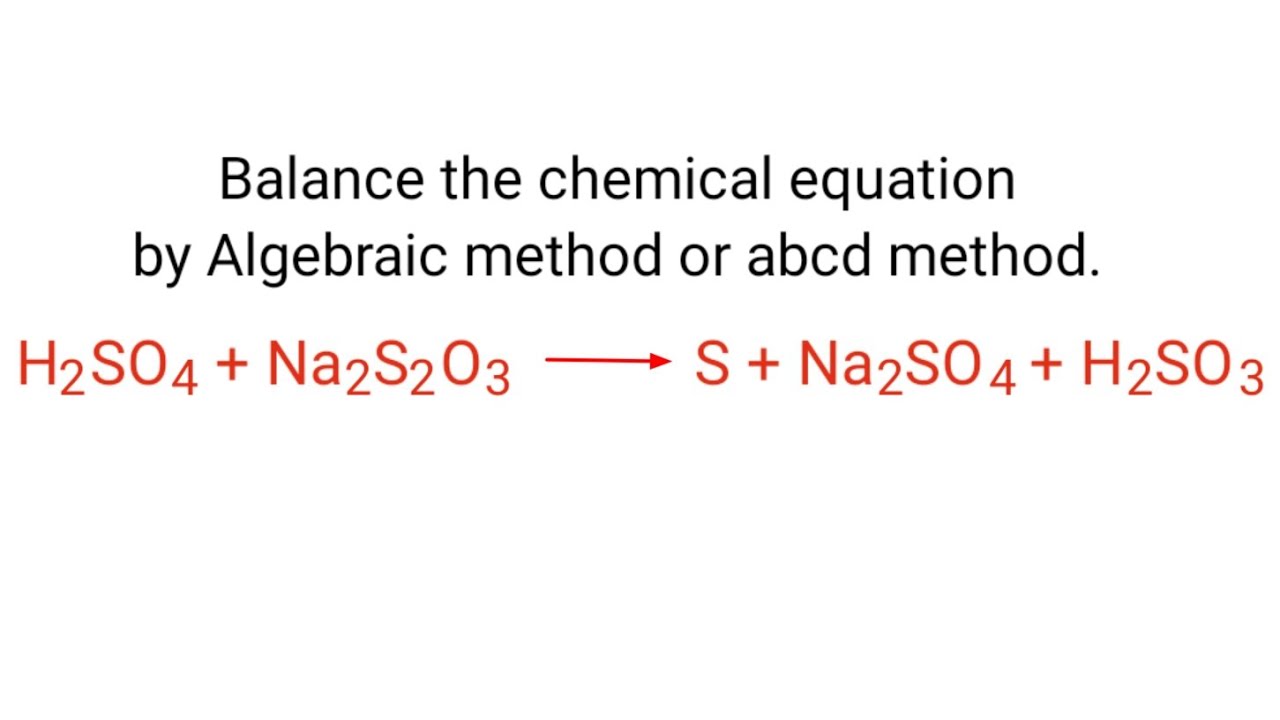

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa natri thiosunfat (Na2S2O3) và axit sulfuric (H2SO4) tạo ra lưu huỳnh, khí sulfur dioxide (SO2) và nước. Đây là một phản ứng oxi hóa khử, trong đó lưu huỳnh trong Na2S2O3 bị oxi hóa từ số oxi hóa +2 lên 0 (lưu huỳnh nguyên chất) và một phần khác bị oxi hóa lên +4 (trong SO2).
Phản ứng hóa học
Phương trình phản ứng cân bằng:
Na2S2O3(aq) + H2SO4(aq) → S(s) + SO2(g) + H2O(l) + Na2SO4(aq)
Lưu ý: Phương trình trên chưa được cân bằng hoàn toàn. Phương trình cân bằng đầy đủ sẽ phụ thuộc vào tỷ lệ mol của các chất tham gia phản ứng. Thường thì phản ứng tạo ra nhiều sản phẩm hơn, bao gồm cả axit sunfuric dư.
Cơ chế phản ứng
Sự oxi hóa khử của lưu huỳnh:
Trong phản ứng này, lưu huỳnh trong Na2S2O3 trải qua quá trình oxi hóa khử. Một phần lưu huỳnh bị oxi hóa thành SO2 (số oxi hóa +4), trong khi phần còn lại bị khử thành lưu huỳnh nguyên tố (số oxi hóa 0). Axit sulfuric đóng vai trò là chất oxi hóa.
Ứng dụng
Ứng dụng trong phòng thí nghiệm:
Phản ứng này thường được sử dụng trong các thí nghiệm hóa học để minh họa phản ứng oxi hóa khử và quan sát hiện tượng tạo thành lưu huỳnh kết tủa và khí SO2.
Lưu ý an toàn:
Khí SO2 là một khí độc hại, gây kích ứng đường hô hấp. Cần tiến hành thí nghiệm trong điều kiện thông gió tốt hoặc sử dụng thiết bị bảo hộ thích hợp.
Xem thêm: vi phan la gi
Sản phẩm hữu ích: sbt lý 11
Sản phẩm hữu ích: quần đảo hoàng sa và trường sa lần lượt thuộc