Mô Hình Hiện Đại Mô Tả Sự Chuyển Động Của Electron Trong Nguyên Tử
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Mô hình hiện đại mô tả sự chuyển động của electron trong nguyên tử không phải là một quỹ đạo tròn cố định như mô hình Bohr. Thay vào đó, nó dựa trên cơ học lượng tử và mô tả vị trí của electron bằng xác suất tìm thấy electron trong không gian xung quanh hạt nhân. Nói cách khác, ta không thể biết chính xác electron ở đâu, mà chỉ biết xác suất tìm thấy nó ở một vị trí nào đó.
Orbital Nguyên Tử: Nơi Ở Xác Suất Của Electron
Khái niệm Orbital
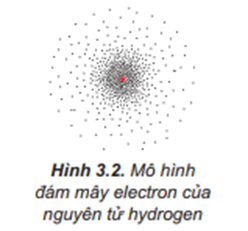
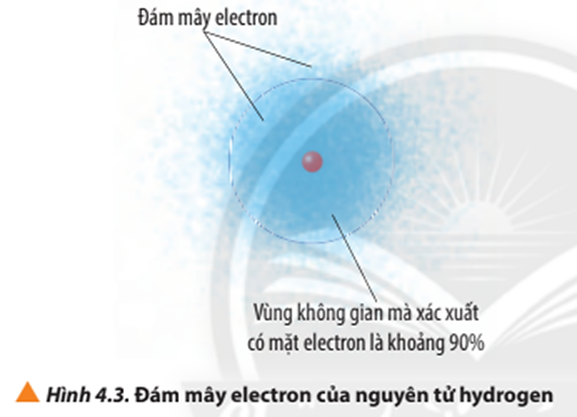
Orbital nguyên tử là vùng không gian xung quanh hạt nhân nguyên tử, nơi có xác suất tìm thấy electron lớn nhất (thường là 90%). Mỗi orbital có hình dạng và năng lượng đặc trưng. Không nên hình dung orbital như một quỹ đạo cố định, mà là một vùng không gian "mờ" thể hiện xác suất tìm thấy electron. Ví dụ, orbital s có hình dạng cầu, orbital p có hình dạng tạ.
Các Số Lượng Tử và Orbital
Sự phân bố electron trong nguyên tử được xác định bởi bốn số lượng tử: số lượng tử chính (n), số lượng tử azimuth (l), số lượng tử từ (ml) và số lượng tử spin (ms). Mỗi bộ số lượng tử này tương ứng với một orbital cụ thể, xác định năng lượng, hình dạng và định hướng không gian của orbital đó.
Đám Mây Electron và Xác Suất
Hình dung sự phân bố electron
Mô hình đám mây electron minh họa trực quan hơn về sự phân bố electron trong nguyên tử. Mật độ của đám mây tại một điểm trong không gian tỷ lệ thuận với xác suất tìm thấy electron tại điểm đó. Vùng mật độ cao hơn nghĩa là xác suất tìm thấy electron ở khu vực đó lớn hơn.
Sự khác biệt với mô hình Bohr
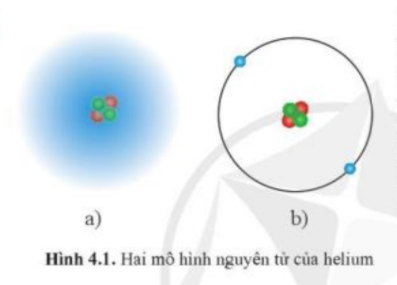
Mô hình Bohr đơn giản hóa quá trình bằng cách mô tả electron chuyển động trên các quỹ đạo tròn xác định. Mô hình hiện đại phức tạp hơn nhiều, nó thừa nhận tính chất sóng - hạt của electron và sử dụng xác suất để mô tả vị trí của electron, mang lại độ chính xác cao hơn trong việc tiên đoán tính chất hóa học của nguyên tố.
Sản phẩm hữu ích: nội dung tích hợp các môn học lớp 3
Sản phẩm liên quan: hình học lớp 2
Sản phẩm liên quan: cách tính điểm trung bình chung tích lũy