Lớp M có số orbital tối đa bằng bao nhiêu?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Lớp M có số orbital tối đa bằng 9.
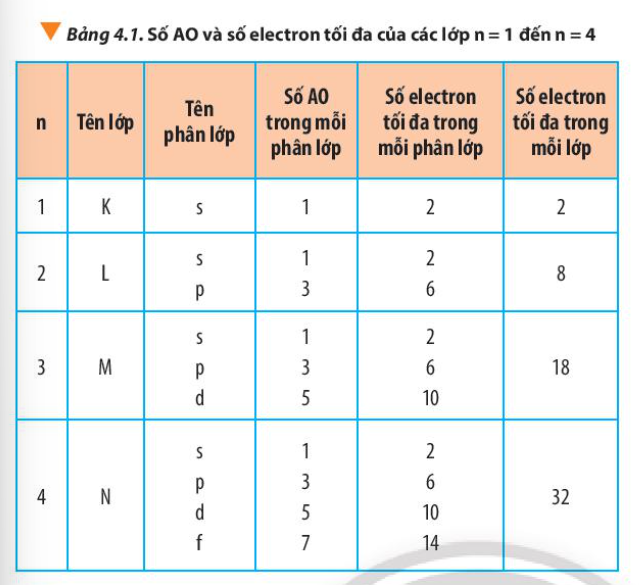
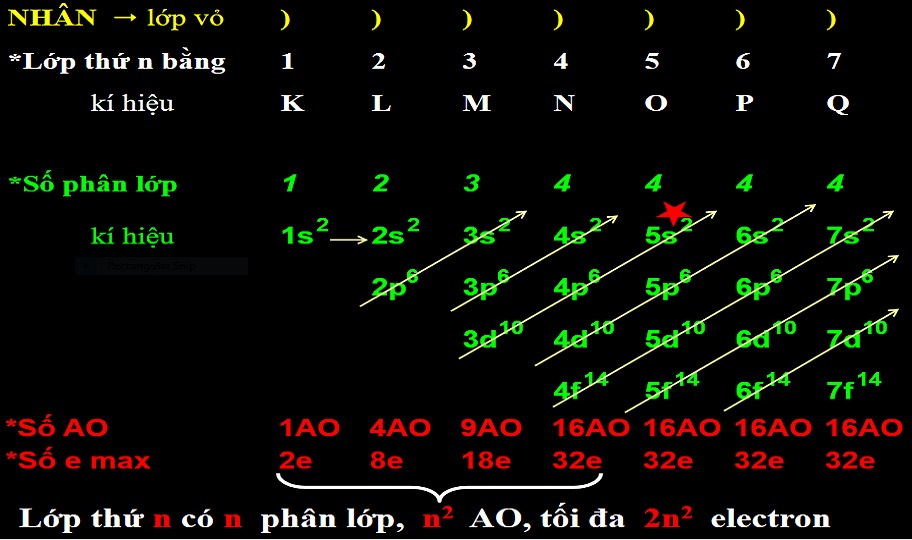
Số orbital tối đa trong mỗi lớp electron
Cách tính số orbital tối đa
Số orbital tối đa trong một lớp electron được tính theo công thức: n2, trong đó n là số thứ tự của lớp electron. Lớp M là lớp electron thứ 3 (n=3), vì vậy số orbital tối đa của lớp M là 32 = 9.
Số electron tối đa trong mỗi lớp electron
Cần phân biệt giữa số orbital tối đa và số electron tối đa. Mỗi orbital có thể chứa tối đa 2 electron (theo nguyên lý Pauli). Do đó, lớp M có thể chứa tối đa 2 * 9 = 18 electron.
Phân bố electron trong lớp M
Các phân lớp trong lớp M
Lớp M bao gồm 3 phân lớp con: 3s, 3p và 3d. Phân lớp 3s có 1 orbital, phân lớp 3p có 3 orbital và phân lớp 3d có 5 orbital. Tổng số orbital là 1 + 3 + 5 = 9 orbital.
Ví dụ về cấu hình electron lớp M
Ví dụ, nguyên tử Ar (Argon) có cấu hình electron là 1s22s22p63s23p6. Lớp M (n=3) của Argon chứa đầy đủ 8 electron (2 trong 3s và 6 trong 3p), chiếm 8 trong 9 orbital của lớp M.
Sản phẩm liên quan: viền bìa tiểu luận
Xem thêm: phản ứng nhiệt hạch là gì
Sản phẩm liên quan: toàn tính la gì
Xem thêm: công thức ghép tụ điện