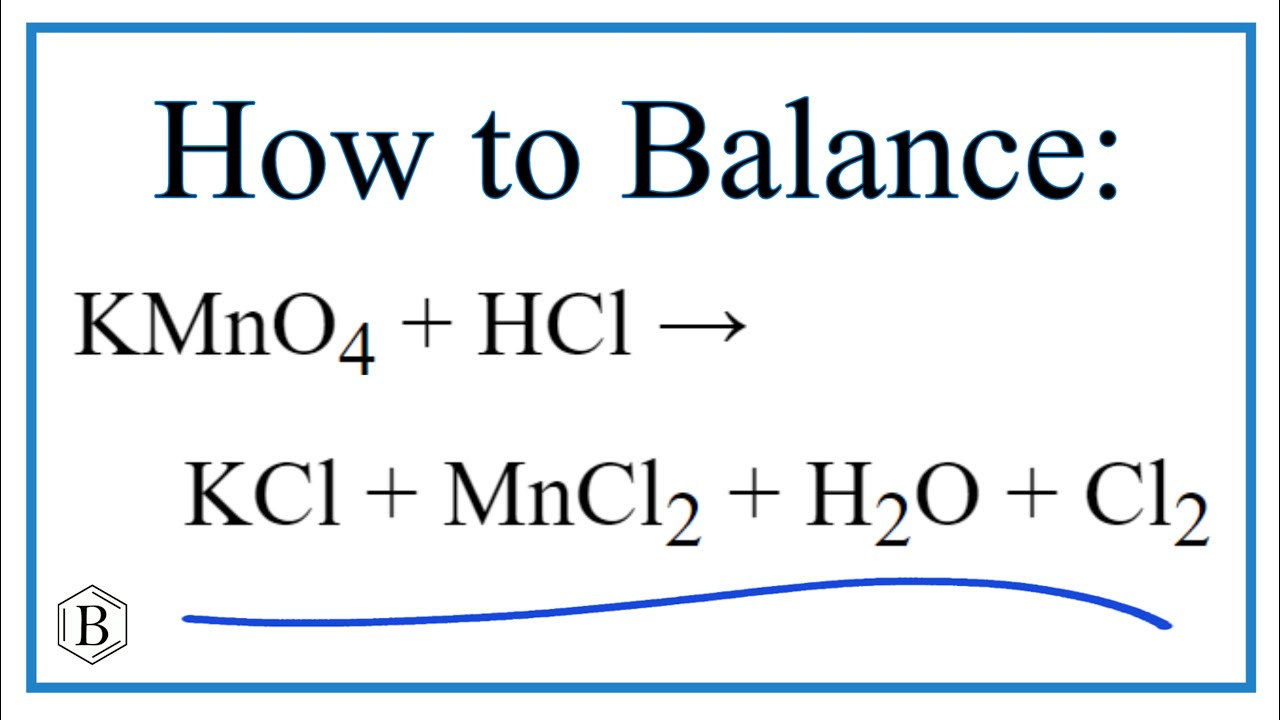
KMnO4 + HCl: Cân bằng electron và phản ứng
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa KMnO4 và HCl là một phản ứng oxi hóa khử, trong đó KMnO4 bị khử và HCl bị oxi hóa. Cân bằng electron cho phản ứng này giúp xác định chính xác tỉ lệ mol giữa các chất tham gia phản ứng.
Phản ứng và cân bằng electron
Bước 1: Viết phản ứng không cân bằng
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Bước 2: Xác định số oxi hóa
KMnO4: Mn có số oxi hóa +7
HCl: Cl có số oxi hóa -1
KCl: Cl có số oxi hóa -1
MnCl2: Mn có số oxi hóa +2
Cl2: Cl có số oxi hóa 0
H2O: H có số oxi hóa +1, O có số oxi hóa -2
Bước 3: Xác định quá trình oxi hóa và khử
Quá trình khử: Mn7+ + 5e- → Mn2+ (KMnO4 nhận 5 electron)
Quá trình oxi hóa: 2Cl- → Cl2 + 2e- (HCl nhường 2 electron)
Bước 4: Cân bằng electron
Để cân bằng electron, ta nhân quá trình oxi hóa với 5 và quá trình khử với 2:
2Mn7+ + 10e- → 2Mn2+
10Cl- → 5Cl2 + 10e-
Bước 5: Viết phương trình cân bằng
Kết hợp hai quá trình, ta được phương trình cân bằng:
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Tổng kết
Phương trình phản ứng cân bằng cho thấy rằng 2 mol KMnO4 phản ứng với 16 mol HCl để tạo ra 2 mol KCl, 2 mol MnCl2, 5 mol Cl2 và 8 mol H2O. Việc cân bằng electron là bước quan trọng để đảm bảo phương trình phản ứng chính xác về mặt số lượng nguyên tử và điện tích.
Sản phẩm liên quan: biểu hiện tinh thần tự học
Sản phẩm hữu ích: động từ chỉ gì
Xem thêm: bài giới thiệu về trường hay nhất