Is NH4 an Acid?

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
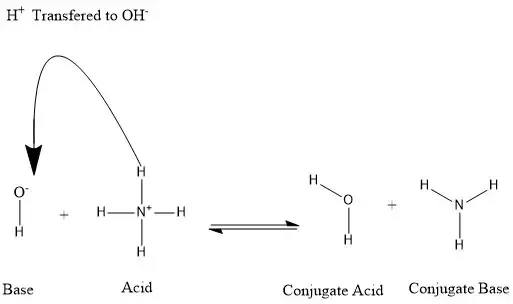
NH4+ (ion amoni) không phải là một axit theo nghĩa truyền thống, nhưng nó có tính axit. Nó hoạt động như một axit yếu vì nó có thể cho đi một proton (ion H+) trong dung dịch nước. Điều này khác với các axit mạnh như HCl, hoàn toàn phân ly thành ion trong nước.
Tính axit của NH4+
Cơ chế cho proton
Tính chất axit của NH4+ xuất phát từ khả năng cho đi một proton (H+) trong dung dịch nước. Phản ứng này tạo ra amoniac (NH3) và một ion hydroni (H3O+):
NH4+ + H2O ⇌ NH3 + H3O+
Sự cân bằng này nằm về phía bên trái, có nghĩa là chỉ một phần nhỏ các ion amoni cho đi proton của chúng. Đây là lý do tại sao NH4+ được coi là một axit yếu.
Độ mạnh của tính axit
Để đánh giá độ mạnh của tính axit, người ta sử dụng hằng số phân ly axit (Ka). Ka của NH4+ tương đối nhỏ, cho thấy nó là một axit yếu. Giá trị Ka thấp phản ánh sự cân bằng nằm về phía bên trái trong phản ứng phân ly, tức là phần lớn các ion NH4+ vẫn không phân ly.
Ứng dụng
Tính axit yếu của NH4+ đóng vai trò quan trọng trong nhiều ứng dụng, bao gồm cả trong nông nghiệp (làm chất điều chỉnh độ pH trong đất) và trong các hệ thống đệm trong sinh học.
Phân biệt với các axit mạnh
Sự khác biệt về độ phân ly
Axit mạnh như HCl phân ly hoàn toàn trong dung dịch nước, trong khi NH4+ chỉ phân ly một phần. Điều này dẫn đến sự khác biệt đáng kể về nồng độ ion H+ trong dung dịch.
Ảnh hưởng đến pH
Do sự phân ly yếu, dung dịch chứa NH4+ sẽ có độ pH ít axit hơn so với dung dịch chứa cùng nồng độ của một axit mạnh.
Sản phẩm hữu ích: co2 tác dụng naoh
Sản phẩm liên quan: bao lực học đường hậu quả
Sản phẩm hữu ích: take sth off là gì