Is NaCl a Base?

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
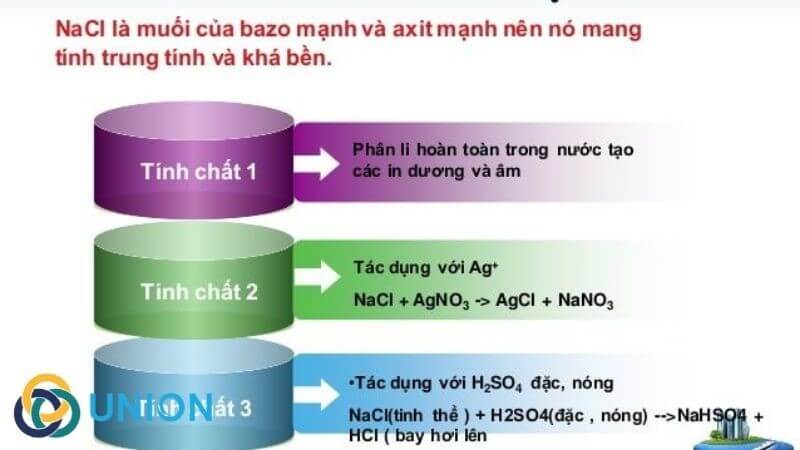
Không, NaCl (natri clorua, hay muối ăn) không phải là một bazơ. NaCl là một muối trung hòa được hình thành từ phản ứng trung hòa giữa một axit mạnh (HCl) và một bazơ mạnh (NaOH).
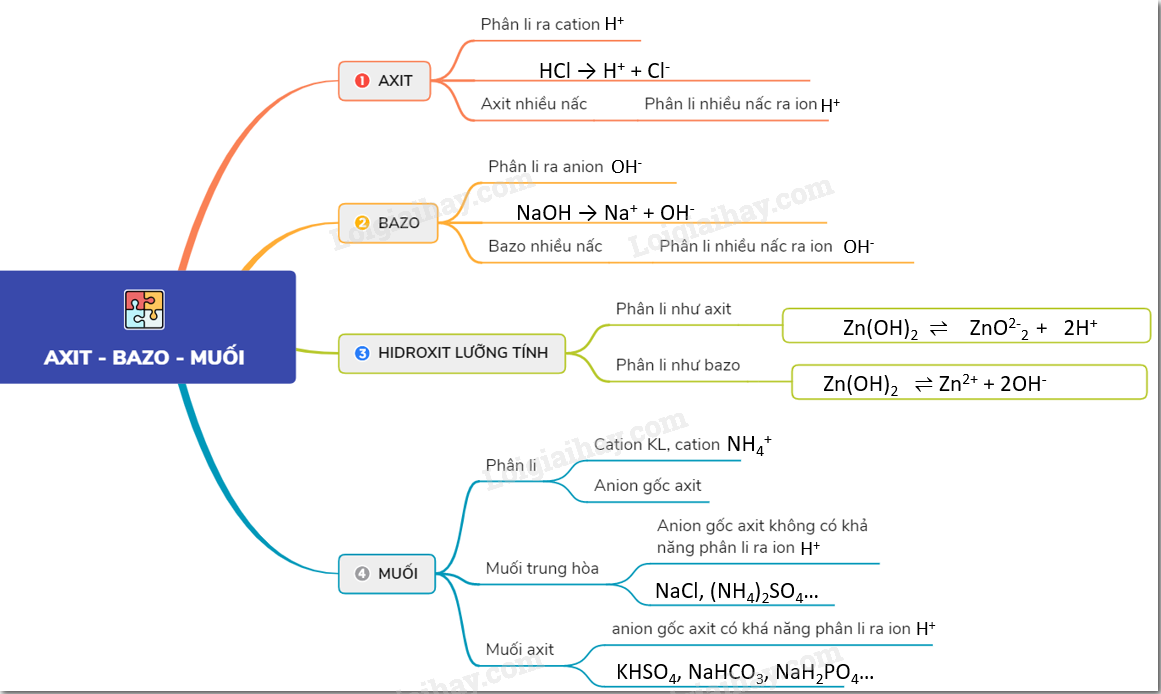
Hiểu về tính axit, bazơ và muối
Tính axit, bazơ và pH
Để hiểu tại sao NaCl không phải là bazơ, chúng ta cần hiểu về thang đo pH. Thang đo pH từ 0 đến 14, với 7 là trung tính. Các chất có pH dưới 7 là axit, trong khi các chất có pH trên 7 là bazơ. Muối, như NaCl, thường có pH gần 7, nghĩa là chúng trung tính.
Phản ứng trung hòa
NaCl được tạo thành từ phản ứng trung hòa giữa axit clohydric (HCl) và natri hydroxit (NaOH):
HCl + NaOH → NaCl + H₂O
Trong phản ứng này, ion H+ từ axit và ion OH- từ bazơ kết hợp tạo thành nước (H₂O), để lại ion Na+ và Cl- tạo thành muối NaCl. Vì cả axit và bazơ phản ứng hoàn toàn, sản phẩm cuối cùng là một dung dịch trung tính.
Tại sao NaCl không có tính bazơ?
Sự phân ly trong nước
Khi NaCl hòa tan trong nước, nó phân ly thành các ion Na+ và Cl-. Cả hai ion này đều không phản ứng đáng kể với nước để tạo ra ion H+ hoặc OH-, vì vậy dung dịch vẫn trung tính. Điều này khác với các bazơ, chúng phân ly trong nước để tạo ra ion OH-, làm tăng độ pH.
Tính chất của muối
Nhìn chung, muối là sản phẩm của phản ứng giữa axit và bazơ. Tính chất của muối phụ thuộc vào sức mạnh của axit và bazơ tạo nên nó. Trong trường hợp NaCl, được tạo ra từ axit mạnh và bazơ mạnh, nó là muối trung hòa và không có tính axit hay bazơ.
Sản phẩm liên quan: tìm tỉ số của hai số lớp 4
Sản phẩm liên quan: ví dụ về cụm từ cố định
Xem thêm: cấu trúc câu cầu khiến
Sản phẩm hữu ích: kẹp file tài liệu