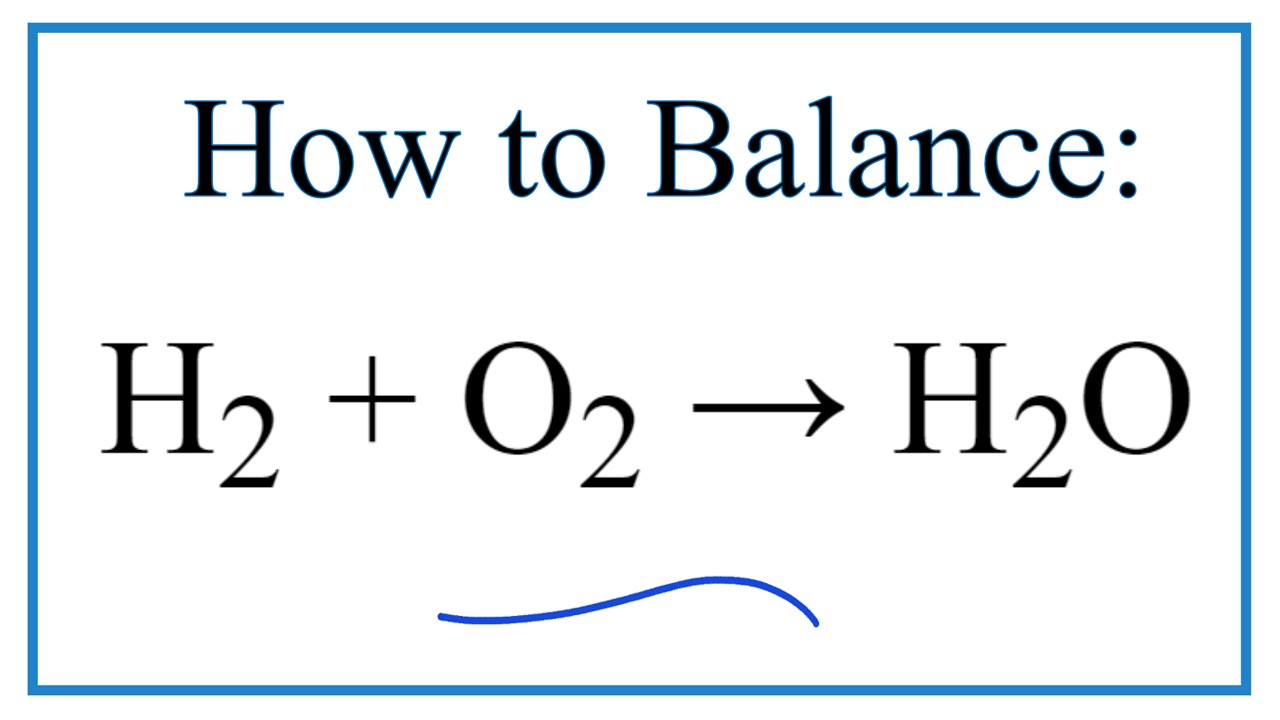
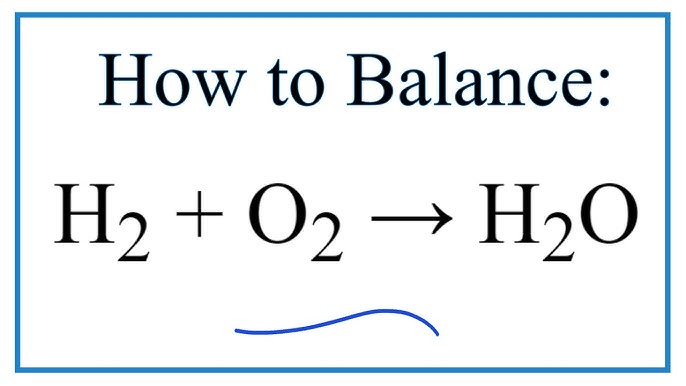
H2 O2 H2O Balanced

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Sự cân bằng giữa H2, O2 và H2O đề cập đến phản ứng hóa học giữa hydro (H2) và oxy (O2) tạo thành nước (H2O). Phản ứng này được biểu diễn bởi phương trình: 2H₂ + O₂ → 2H₂O. Đây là một phản ứng tỏa nhiệt mạnh, giải phóng một lượng lớn năng lượng dưới dạng nhiệt và ánh sáng. Sự cân bằng trong trường hợp này đề cập đến tỷ lệ mol giữa các chất tham gia phản ứng và sản phẩm. Để đạt được phản ứng hoàn toàn, cần có tỷ lệ 2:1 giữa hydro và oxy.
Hiểu về sự cân bằng H2, O2 và H2O
Vai trò của Hydro (H2)
Hydro là một nguyên tố nhẹ, dễ cháy và rất quan trọng trong nhiều lĩnh vực, bao gồm sản xuất amoniac, lọc dầu và nhiên liệu. Trong phản ứng với oxy, hydro đóng vai trò là chất khử.Vai trò của Oxy (O2)
Oxy là một chất khí thiết yếu cho sự sống và đóng vai trò quan trọng trong quá trình hô hấp. Trong phản ứng với hydro, oxy đóng vai trò là chất oxi hóa.Vai trò của Nước (H2O)
Nước là sản phẩm của phản ứng giữa hydro và oxy. Nó là một hợp chất quan trọng trong tự nhiên và có vai trò thiết yếu trong nhiều quá trình sinh học và công nghiệp.Ứng dụng của sự cân bằng H2, O2 và H2O
Sản xuất năng lượng
Phản ứng giữa hydro và oxy được sử dụng trong pin nhiên liệu để sản xuất điện sạch. Đây là một công nghệ năng lượng bền vững hứa hẹn cho tương lai.Công nghiệp hóa chất
Sự cân bằng giữa H2, O2 và H2O có vai trò quan trọng trong nhiều quá trình sản xuất hóa chất, ví dụ như sản xuất amoniac, hydro peroxide, và nhiều hợp chất khác.Ứng dụng khác
Ngoài ra, sự hiểu biết về cân bằng H2, O2 và H2O còn được ứng dụng trong nhiều lĩnh vực khác như nghiên cứu khí quyển, mô phỏng khí hậu và xử lý nước thải.Xem thêm: tchh của kim loại
Sản phẩm liên quan: nh4cl tạo ra nh3
Sản phẩm hữu ích: fe(no3)3 + agno3 dư
Sản phẩm liên quan: anhxtanh phát minh ra gì