FeSO4 ra Fe(OH)2: Phản ứng và Điều kiện
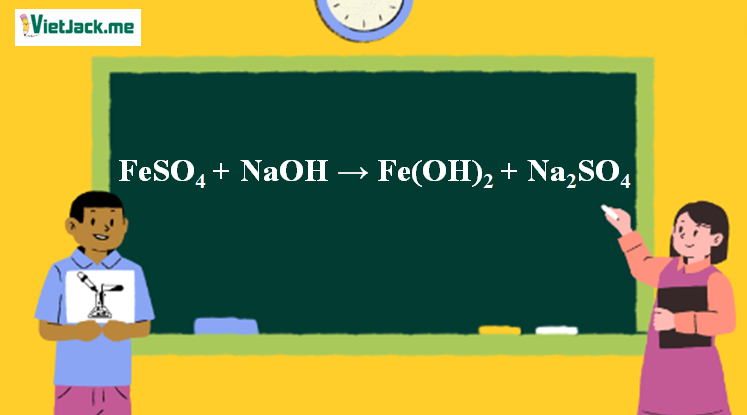
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Muối sắt (II) sunfat (FeSO4) phản ứng với dung dịch kiềm như NaOH hay KOH tạo ra kết tủa sắt (II) hydroxit Fe(OH)2 màu trắng xanh. Đây là một phản ứng trao đổi, trong đó cation Fe2+ kết hợp với anion OH- tạo thành Fe(OH)2 không tan.
Phản ứng hóa học
Phương trình phản ứng
Phương trình ion rút gọn của phản ứng là: Fe2+ + 2OH- → Fe(OH)2↓
Phương trình phản ứng đầy đủ khi dùng NaOH là: FeSO4 + 2NaOH → Fe(OH)2↓ + Na2SO4
Điều kiện phản ứng
Môi trường phản ứng
Phản ứng xảy ra trong môi trường trung tính hoặc kiềm yếu. Nếu môi trường quá axit, phản ứng sẽ không xảy ra hoặc xảy ra rất chậm do ion OH- bị trung hòa.
Nồng độ chất tham gia
Nồng độ của FeSO4 và dung dịch kiềm ảnh hưởng đến tốc độ phản ứng và lượng kết tủa Fe(OH)2 tạo thành. Nồng độ càng cao, phản ứng diễn ra càng nhanh và tạo ra nhiều kết tủa hơn.
Nhiệt độ
Nhiệt độ cũng ảnh hưởng đến tốc độ phản ứng. Ở nhiệt độ cao, phản ứng diễn ra nhanh hơn.
Ứng dụng
Phản ứng này được ứng dụng trong nhiều lĩnh vực hóa học, ví dụ như:
- Tổng hợp các hợp chất sắt khác.
- Phân tích định tính và định lượng ion Fe2+.
- Điều chế Fe(OH)2 trong phòng thí nghiệm.
Lưu ý an toàn
Khi tiến hành thí nghiệm, cần tuân thủ các quy tắc an toàn trong phòng thí nghiệm hóa học, như đeo găng tay, kính bảo hộ và làm thí nghiệm trong tủ hút để tránh hít phải các chất độc hại.
Sản phẩm liên quan: cách chia số đo thời gian
Xem thêm: drop back là gì
Sản phẩm liên quan: ca(oh)2 + so2 = ca(hso3)2
Xem thêm: vùi dập là gì