E lớp ngoài cùng là gì?
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
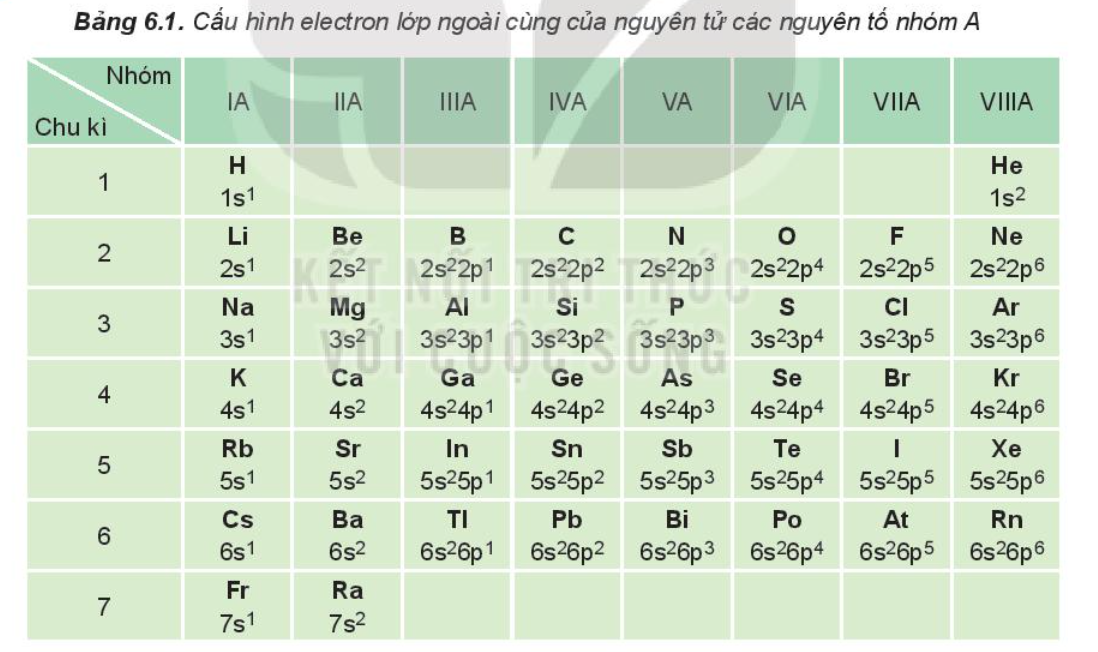
E lớp ngoài cùng, hay còn gọi là electron hóa trị, là các electron nằm ở lớp electron ngoài cùng của nguyên tử. Đây là những electron tham gia vào sự hình thành liên kết hóa học giữa các nguyên tử, quyết định tính chất hóa học của nguyên tố. Vậy nên hiểu rõ về e lớp ngoài cùng rất quan trọng trong hóa học.
Vai trò của e lớp ngoài cùng
Trong phản ứng hóa học
Các nguyên tử có xu hướng đạt được cấu hình electron bền vững giống như khí hiếm (8 electron ở lớp ngoài cùng, trừ Heli chỉ có 2). Để đạt được điều này, nguyên tử sẽ tham gia vào phản ứng hóa học, nhận hoặc cho đi electron lớp ngoài cùng để tạo thành liên kết ion hoặc liên kết cộng hóa trị. Số electron lớp ngoài cùng quyết định khả năng tạo liên kết và loại liên kết được tạo thành. Ví dụ, nguyên tử Natri (Na) có 1 electron lớp ngoài cùng, dễ dàng cho đi electron này để tạo thành ion Na+ và liên kết ion với các nguyên tố khác.Trong tính chất hóa học
Số lượng electron lớp ngoài cùng ảnh hưởng trực tiếp đến tính chất hóa học của nguyên tố. Các nguyên tố có số electron lớp ngoài cùng tương tự nhau thường có tính chất hóa học tương tự. Ví dụ, các nguyên tố nhóm IA (kim loại kiềm) đều có 1 electron lớp ngoài cùng và đều có tính khử mạnh.Cách xác định e lớp ngoài cùng
Dựa vào cấu hình electron
Cấu hình electron cho biết sự phân bố electron trong các lớp và phân lớp của nguyên tử. Lớp electron ngoài cùng là lớp có mức năng lượng cao nhất. Ví dụ, cấu hình electron của Natri là 1s22s22p63s1. Lớp ngoài cùng là lớp 3, có 1 electron. Do đó, Natri có 1 electron lớp ngoài cùng.Dựa vào số thứ tự của nguyên tố trong bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn cũng cho biết số electron lớp ngoài cùng. Số nhóm A của nguyên tố thường bằng số electron lớp ngoài cùng (trừ nhóm VIIIA). Ví dụ, Natri thuộc nhóm IA, có 1 electron lớp ngoài cùng.Sản phẩm hữu ích: nhiệt độ nóng chảy của đường
Sản phẩm hữu ích: tứ phân vị toán 10
Sản phẩm hữu ích: muốn tính chiều cao của hình hộp chữ nhật
Sản phẩm liên quan: tam giác cân có đường cao
Sản phẩm hữu ích: gạch sỏi lát nền nhà tắm