Điều Kiện Chuẩn Của Khí


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
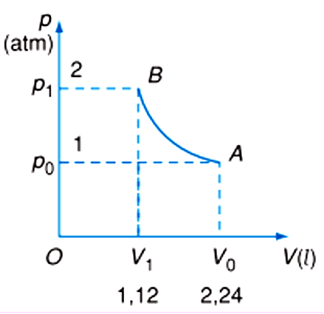
Điều kiện chuẩn của khí là nhiệt độ 0 độ C (273.15 K) và áp suất 1 atm (101.325 kPa). Đây là điều kiện được sử dụng rộng rãi trong các phép tính và nghiên cứu về khí lý tưởng.
Tại sao điều kiện chuẩn lại quan trọng?
Tính toán chính xác
Nhiều công thức và phương trình trong hóa học và vật lý sử dụng điều kiện chuẩn để tính toán các đại lượng liên quan đến khí, như thể tích, khối lượng, mật độ... Việc sử dụng điều kiện chuẩn đảm bảo tính nhất quán và chính xác của các kết quả tính toán.So sánh dễ dàng
Khi các thí nghiệm hay phép tính được thực hiện ở điều kiện chuẩn, việc so sánh kết quả giữa các thí nghiệm khác nhau trở nên dễ dàng hơn. Điều này giúp đánh giá hiệu quả của các quá trình và rút ra các kết luận đáng tin cậy.Ứng dụng thực tiễn
Điều kiện chuẩn không chỉ quan trọng trong lý thuyết mà còn được ứng dụng rộng rãi trong thực tiễn, chẳng hạn như trong các ngành công nghiệp sản xuất, hóa chất, khí tượng học… Hiểu rõ điều kiện chuẩn giúp đảm bảo tính chính xác và hiệu quả của các quy trình sản xuất và nghiên cứu.Các yếu tố ảnh hưởng đến trạng thái khí
Nhiệt độ
Nhiệt độ ảnh hưởng trực tiếp đến chuyển động của các phân tử khí. Nhiệt độ càng cao, các phân tử chuyển động càng nhanh và mạnh, dẫn đến thể tích khí tăng lên.Áp suất
Áp suất là lực tác động lên một đơn vị diện tích. Áp suất cao sẽ làm giảm thể tích của khí.Thể tích
Thể tích là không gian mà khí chiếm giữ. Thể tích thay đổi tùy thuộc vào nhiệt độ và áp suất.Khí lý tưởng và khí thực
Khí lý tưởng
Khí lý tưởng là một mô hình lý tưởng hóa, trong đó các phân tử khí được coi là không có thể tích và không có tương tác giữa các phân tử. Điều kiện chuẩn giúp đơn giản hóa việc tính toán đối với khí lý tưởng.Khí thực
Khí thực khác với khí lý tưởng, các phân tử khí thực có thể tích và có tương tác giữa chúng. Tuy nhiên, ở điều kiện chuẩn, nhiều khí thực có thể được xấp xỉ như khí lý tưởng.Sản phẩm hữu ích: ăn gì để nước ối sạch
Xem thêm: con sên có mấy cái mũi
Sản phẩm hữu ích: vó bò là gì
Sản phẩm hữu ích: đi na mô xe đạp