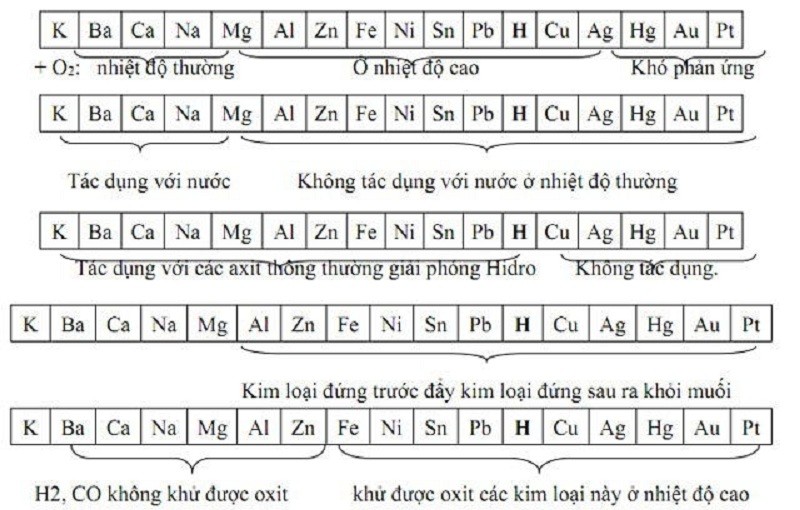
Dãy Điện Hóa Học

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Dãy điện hóa học là một bảng liệt kê các kim loại và phi kim theo thứ tự giảm dần tính khử (tăng dần tính oxi hóa) của chúng. Nó giúp dự đoán khả năng phản ứng oxi hóa-khử của các chất, đặc biệt là trong các phản ứng điện hóa.
Ứng dụng của dãy điện hóa học
Dự đoán phản ứng oxi hóa-khử:
Dựa vào vị trí của các chất trong dãy điện hóa, ta có thể dự đoán được khả năng xảy ra phản ứng oxi hóa-khử. Chất có tính khử mạnh hơn sẽ bị oxi hóa, còn chất có tính oxi hóa mạnh hơn sẽ bị khử. Ví dụ, kim loại đứng trước trong dãy điện hóa sẽ phản ứng được với dung dịch muối của kim loại đứng sau nó.Xác định chiều của phản ứng điện hóa:
Dãy điện hóa cho phép xác định chiều dòng điện trong pin điện hóa. Electron sẽ di chuyển từ cực âm (kim loại có tính khử mạnh hơn) sang cực dương (kim loại có tính khử yếu hơn).Tính toán thế điện cực chuẩn:
Dãy điện hóa cung cấp thông tin về thế điện cực chuẩn của các chất, giúp tính toán sức điện động của pin điện hóa.Ứng dụng trong công nghiệp:
Dãy điện hóa được ứng dụng rộng rãi trong nhiều lĩnh vực công nghiệp, chẳng hạn như sản xuất pin, điện phân, bảo vệ kim loại khỏi ăn mòn…Cấu tạo của dãy điện hóa học
Thứ tự sắp xếp:
Các chất trong dãy điện hóa được sắp xếp theo thứ tự giảm dần thế điện cực chuẩn (E0). Chất có thế điện cực chuẩn càng lớn thì tính oxi hóa càng mạnh, và ngược lại.Các chất tham gia:
Dãy điện hóa bao gồm các kim loại, phi kim và ion của chúng.Thông tin bổ sung:
Bên cạnh thế điện cực chuẩn, dãy điện hóa đôi khi cũng cung cấp thêm thông tin về các điều kiện phản ứng (ví dụ: môi trường axit hay bazơ).Ví dụ về ứng dụng thực tiễn
Một ví dụ đơn giản là việc dự đoán phản ứng giữa kim loại kẽm (Zn) và dung dịch đồng sunfat (CuSO4). Vì Zn đứng trước Cu trong dãy điện hóa, Zn có tính khử mạnh hơn Cu, do đó Zn sẽ bị oxi hóa và Cu2+ sẽ bị khử, tạo ra dung dịch ZnSO4 và kim loại Cu.Xem thêm: mua búp bê tình dục
Sản phẩm hữu ích: khái niệm nào đúng về công cơ học
Xem thêm: tam giác cân bao nhiêu độ