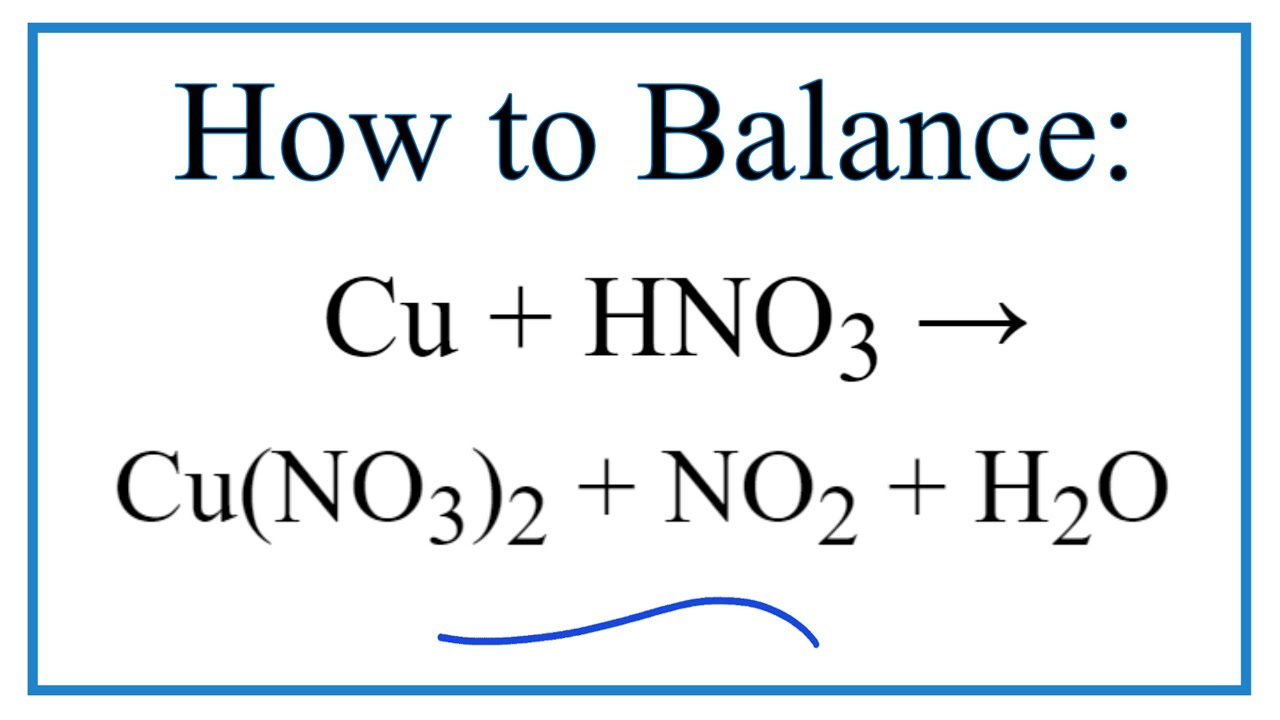
Phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng Cu + HNO3 tạo ra Cu(NO3)2, NO và H2O là một phản ứng oxi hóa khử, trong đó đồng (Cu) bị oxi hóa thành ion đồng (II) (Cu2+), và axit nitric (HNO3) bị khử thành nitơ monoxit (NO). Đây là một phản ứng khá phức tạp và cần cân bằng phương trình phản ứng để hiểu rõ hơn về số mol các chất tham gia và sản phẩm.
Cân bằng phương trình phản ứng Cu + HNO3 → Cu(NO3)2 + NO + H2O
Phương pháp cân bằng
Để cân bằng phương trình này, ta cần sử dụng phương pháp cân bằng electron. Đầu tiên, xác định số oxi hóa của các nguyên tố trong phản ứng:- Cu: 0 → +2 (mất 2e)
- N (+5 trong HNO3) → +2 (trong NO) (thu 3e)
3Cu + ?HNO3 → 3Cu(NO3)2 + 2NO + ?H2O
Tiếp theo, cân bằng các nguyên tố khác:- Nitơ (N): 8 nguyên tử N ở vế phải, cần 8 HNO3 ở vế trái
- Hiđro (H): 8 nguyên tử H ở vế trái, cần 4 H2O ở vế phải
- Oxy (O): 24 nguyên tử O ở vế trái, 24 nguyên tử O ở vế phải
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Điều kiện phản ứng và ứng dụng
Điều kiện phản ứng
Phản ứng này thường xảy ra ở điều kiện thường hoặc đun nóng nhẹ. Nồng độ của axit nitric cũng ảnh hưởng đến sản phẩm tạo thành. Với HNO3 đặc, sản phẩm khử có thể là NO2 hoặc thậm chí N2O4.Ứng dụng
Phản ứng này được ứng dụng trong nhiều lĩnh vực hóa học, chẳng hạn như:- Tổng hợp các hợp chất đồng(II).
- Sản xuất NO, một chất trung gian quan trọng trong công nghiệp hóa chất.
- Nghiên cứu trong lĩnh vực hóa học vô cơ.
Sản phẩm hữu ích: tra cứu điểm thi kangaroo 2023
Xem thêm: hbr là axit gì
Xem thêm: nitric acid and barium hydroxide