Công thức Lewis của CS2
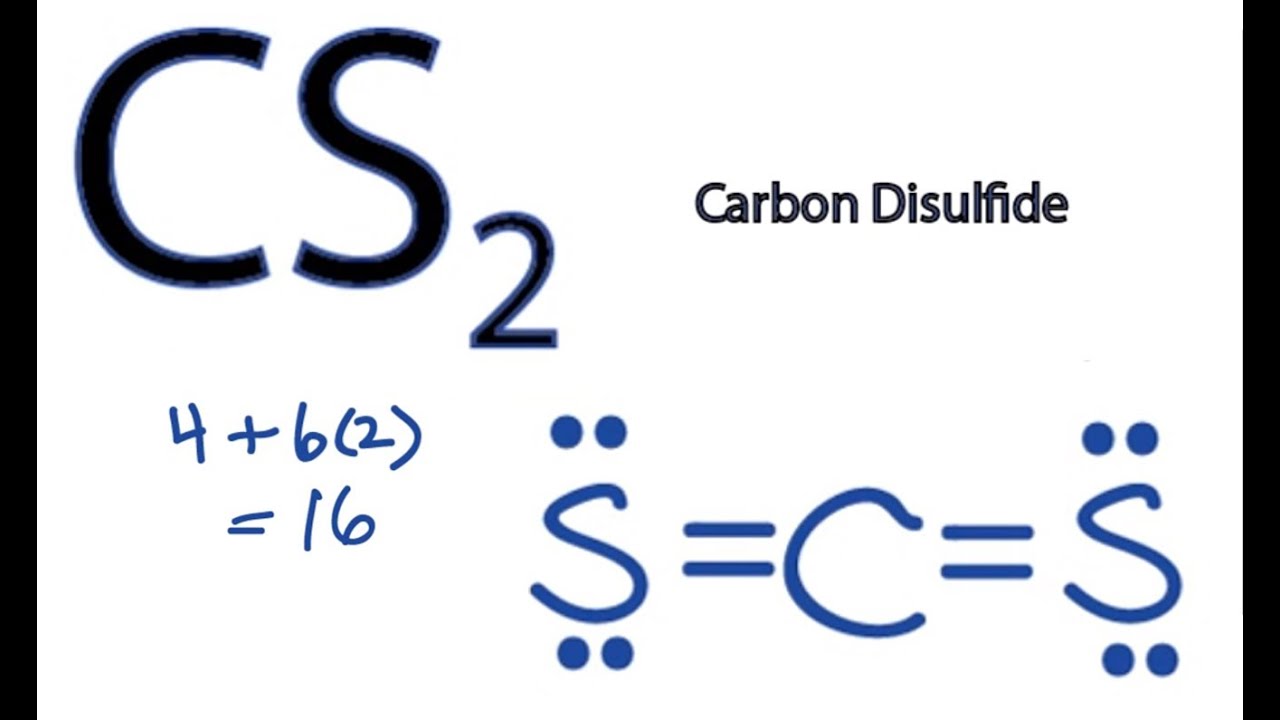
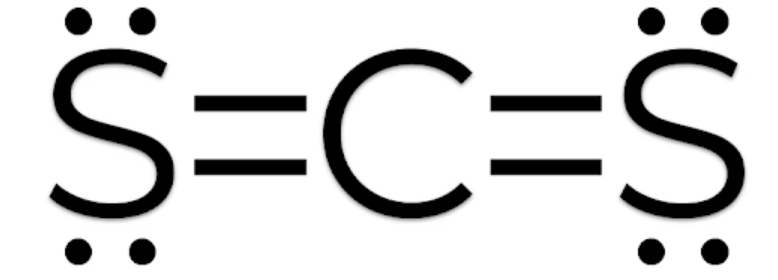
Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Công thức Lewis của CS2 là S=C=S, với mỗi nguyên tử lưu huỳnh có hai cặp electron không liên kết.
Tổng quan về Công thức Lewis của CS2
Bước 1: Xác định số electron hóa trị
Cacbon có 4 electron hóa trị, mỗi nguyên tử lưu huỳnh có 6 electron hóa trị. Tổng cộng là 4 + 6 + 6 = 16 electron hóa trị.Bước 2: Xác định nguyên tử trung tâm
Cacbon là nguyên tử trung tâm vì nó có độ âm điện thấp hơn lưu huỳnh.Bước 3: Vẽ khung xương
Khung xương có dạng S-C-S.Bước 4: Đặt electron vào liên kết
Mỗi liên kết đơn sử dụng 2 electron. Chúng ta sử dụng 4 electron để tạo hai liên kết đơn giữa cacbon và hai nguyên tử lưu huỳnh (S-C-S). Điều này để lại 12 electron.Bước 5: Đặt các electron còn lại thành các cặp electron không liên kết
Phân bổ đều 12 electron còn lại vào các nguyên tử lưu huỳnh, mỗi nguyên tử nhận được 3 cặp electron không liên kết.Bước 6: Kiểm tra quy tắc octet
Cacbon có 8 electron xung quanh nó (4 từ hai liên kết đôi), đáp ứng quy tắc octet. Mỗi nguyên tử lưu huỳnh có 8 electron xung quanh nó (2 từ liên kết đôi và 6 từ 3 cặp electron không liên kết), cũng đáp ứng quy tắc octet.Bước 7: Công thức Lewis cuối cùng
Công thức Lewis cuối cùng cho CS2 là S=C=S, với mỗi nguyên tử lưu huỳnh có hai cặp electron không liên kết. Lưu ý rằng liên kết đôi giữa cacbon và mỗi lưu huỳnh tạo ra một liên kết ba điện tử trên mỗi nguyên tử.Tính chất của CS2
CS2, hay carbon disulfide, là một chất lỏng không màu, dễ bay hơi, có mùi thơm dễ chịu đặc trưng. Tuy nhiên, nó là một chất cực kỳ dễ cháy và độc hại.Ứng dụng của CS2
CS2 được sử dụng trong nhiều ứng dụng công nghiệp, bao gồm sản xuất rayon, carbon tetrachloride, và một số loại thuốc trừ sâu.Sản phẩm hữu ích: tiếng anh 10 discovery
Xem thêm: dụng cụ thí nghiệm
Sản phẩm liên quan: 2 lực đồng quy
Sản phẩm hữu ích: ron tủ lạnh mua ở đâu