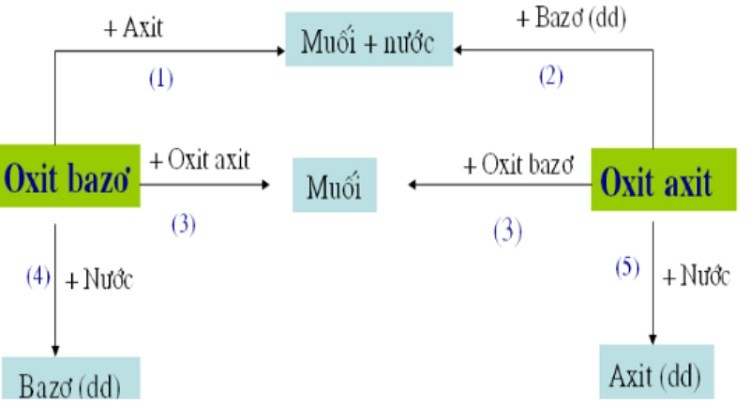
Công thức hóa học của oxit bazơ

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Công thức hóa học chung của oxit bazơ là MxOy, trong đó M là kim loại và O là oxi. x và y là các chỉ số thể hiện số nguyên tử của kim loại và oxi trong phân tử.
Phân loại oxit bazơ
Oxit bazơ của kim loại kiềm và kiềm thổ
Công thức hóa học của oxit bazơ của kim loại kiềm (nhóm IA) có dạng R2O, ví dụ như Na2O (natri oxit), K2O (kali oxit). Oxit bazơ của kim loại kiềm thổ (nhóm IIA) có dạng RO, ví dụ như MgO (magie oxit), CaO (canxi oxit).Oxit bazơ của kim loại chuyển tiếp
Oxit bazơ của kim loại chuyển tiếp thường có nhiều hóa trị khác nhau, dẫn đến nhiều công thức khác nhau. Ví dụ, sắt có thể tạo ra FeO (sắt(II) oxit) và Fe2O3 (sắt(III) oxit). Tương tự, đồng có Cu2O (đồng(I) oxit) và CuO (đồng(II) oxit). Việc xác định công thức chính xác phụ thuộc vào hóa trị của kim loại trong hợp chất cụ thể.Một số ví dụ khác về oxit bazơ
Ngoài các ví dụ trên, còn rất nhiều oxit bazơ khác như: Al2O3 (nhôm oxit), ZnO (kẽm oxit), Fe3O4 (oxit sắt từ),... Công thức hóa học cụ thể phụ thuộc vào loại kim loại và hóa trị của nó.Lưu ý: Việc xác định công thức hóa học của oxit bazơ cần dựa trên hóa trị của kim loại. Hóa trị của kim loại thường được xác định thông qua bảng tuần hoàn các nguyên tố hóa học hoặc thông qua các phản ứng hóa học.
Hiểu rõ về công thức hóa học của oxit bazơ là nền tảng quan trọng để nắm vững kiến thức hóa học về các phản ứng hóa học liên quan đến oxit bazơ.
Sản phẩm liên quan: cách trồng măng cụt
Xem thêm: nhiệt phân fe(oh)3
Xem thêm: bút vẽ vải không bay màu
Sản phẩm hữu ích: bé dâu và anh hạt dẻ