Phản ứng CO32- + H+
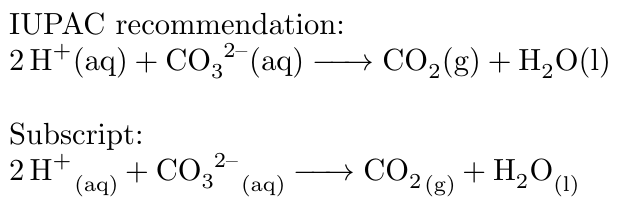


Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa ion cacbonat (CO32-) và ion hydro (H+) tạo ra ion bicacbonat (HCO3-). Đây là phản ứng trung hòa, một phản ứng acid-base. Cụ thể, CO32- là một base yếu và H+ là một acid mạnh, phản ứng tạo ra một dung dịch có tính base yếu hơn.
Chi tiết phản ứng CO32- + H+
Phương trình phản ứng
Phương trình phản ứng cân bằng là: CO32- + H+ ⇌ HCO3-
Như bạn thấy, phản ứng này là một phản ứng thuận nghịch, có nghĩa là nó xảy ra cả theo chiều thuận (từ trái sang phải) và chiều nghịch (từ phải sang trái). Sự cân bằng sẽ lệch về phía nào phụ thuộc vào nồng độ của các chất tham gia và điều kiện phản ứng (như nhiệt độ và áp suất).
Tính chất của các chất tham gia
Ion cacbonat (CO32-) là một base yếu, có khả năng nhận proton (H+) từ các acid. Ion hydro (H+) là một acid mạnh, dễ dàng nhường proton.
Ứng dụng
Phản ứng này có nhiều ứng dụng trong hóa học, đặc biệt trong hóa học dung dịch. Ví dụ, nó được sử dụng trong việc xác định nồng độ của các dung dịch chứa ion cacbonat hoặc ion hydro. Nó cũng đóng vai trò quan trọng trong các hệ thống đệm, giúp duy trì độ pH ổn định.
Các yếu tố ảnh hưởng đến phản ứng
Nồng độ chất phản ứng
Nồng độ của CO32- và H+ ảnh hưởng trực tiếp đến tốc độ và mức độ hoàn toàn của phản ứng. Nồng độ càng cao, phản ứng xảy ra càng nhanh và hoàn toàn hơn.
Nhiệt độ
Nhiệt độ cũng là một yếu tố quan trọng. Thông thường, tăng nhiệt độ sẽ làm tăng tốc độ phản ứng.
Chất xúc tác
Một số chất xúc tác có thể làm tăng tốc độ phản ứng, nhưng thường không cần thiết trong trường hợp này.
Xem thêm: so2 + h2o + kmno4
Sản phẩm liên quan: cách tính thứ của một ngày bất kỳ trong năm
Sản phẩm hữu ích: thuốc canxi viên sủi