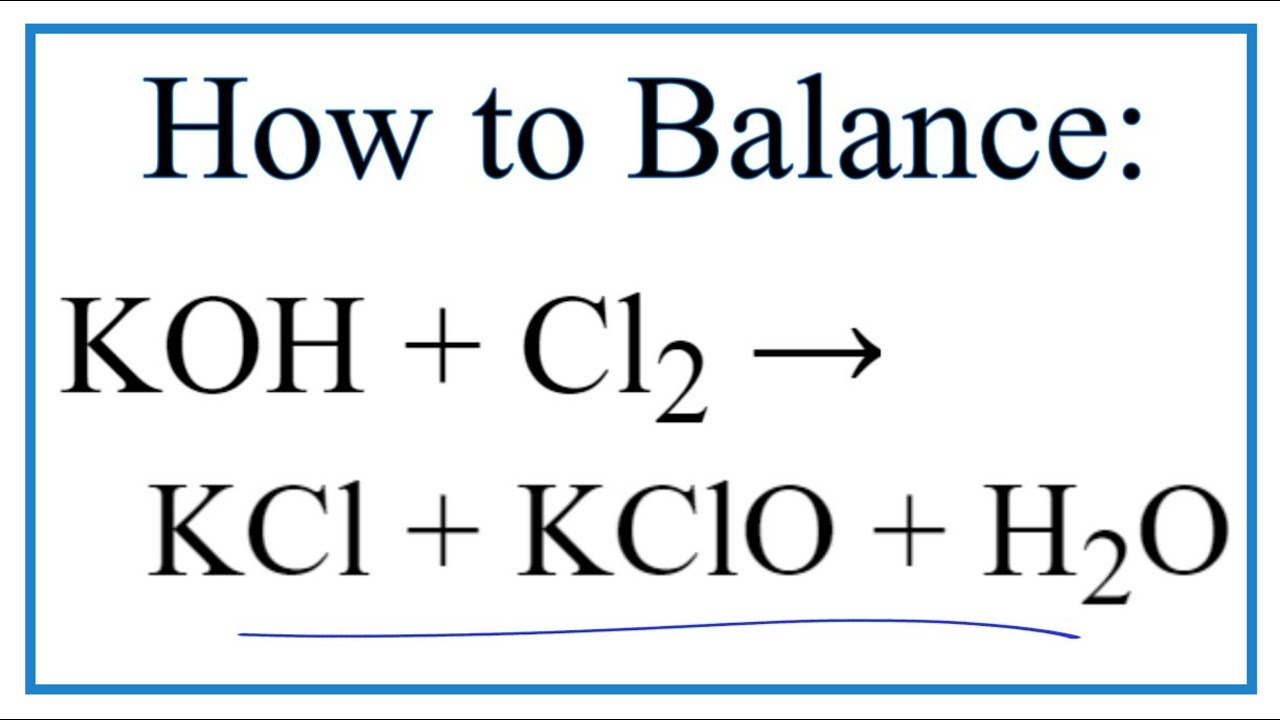
Cân bằng phương trình Cl2 + KOH
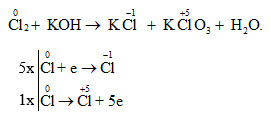

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Phản ứng giữa Cl2 và KOH là phản ứng oxi hóa khử, tạo ra muối kali clorua (KCl), kali hipoclorit (KClO) và nước (H2O). Phương trình cân bằng là: 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
Chi tiết phản ứng cân bằng Cl2 + KOH
Các bước cân bằng phương trình
Để cân bằng phương trình hóa học Cl2 + KOH, ta cần tuân thủ theo định luật bảo toàn khối lượng. Quá trình cân bằng gồm các bước sau:
- Xác định số oxi hóa của các nguyên tố trong phản ứng. Clo (Cl) có số oxi hóa thay đổi từ 0 lên +1 và -1.
- Viết các bán phản ứng oxi hóa và khử:
- Oxi hóa: Cl2 → 2Cl+ + 2e-
- Khử: Cl2 + 2e- → 2Cl-
- Nhân các bán phản ứng với các hệ số thích hợp để số electron cho bằng số electron nhận. Trong trường hợp này, ta nhân bán phản ứng oxi hóa với 1 và bán phản ứng khử với 1.
- Cộng các bán phản ứng lại với nhau để tạo ra phản ứng tổng thể:
- Thêm các ion K+ và OH- vào hai bên để cân bằng điện tích và tạo thành các hợp chất.
- Cân bằng số nguyên tử của các nguyên tố khác.
- Kiểm tra lại xem phương trình đã cân bằng hay chưa.
2Cl2 + 2e- → 2Cl- + 2Cl+
Sản phẩm của phản ứng
Sản phẩm của phản ứng giữa Cl2 và KOH gồm có:
- Kali clorua (KCl): Muối trung hòa.
- Kali hipoclorit (KClO): Muối có tính oxi hóa mạnh.
- Nước (H2O).
Tùy thuộc vào điều kiện phản ứng (nhiệt độ, nồng độ của các chất tham gia) mà tỉ lệ sản phẩm có thể thay đổi. Tuy nhiên, phương trình cân bằng nêu trên là phương trình tổng quát cho phản ứng này.
Sản phẩm hữu ích: buoi toi vui ve
Xem thêm: bài thu hoạch về bảo tàng chăm đà nẵng
Sản phẩm hữu ích: fit out trong xây dựng là gì