Electron được điền vào orbital theo thứ tự nào?
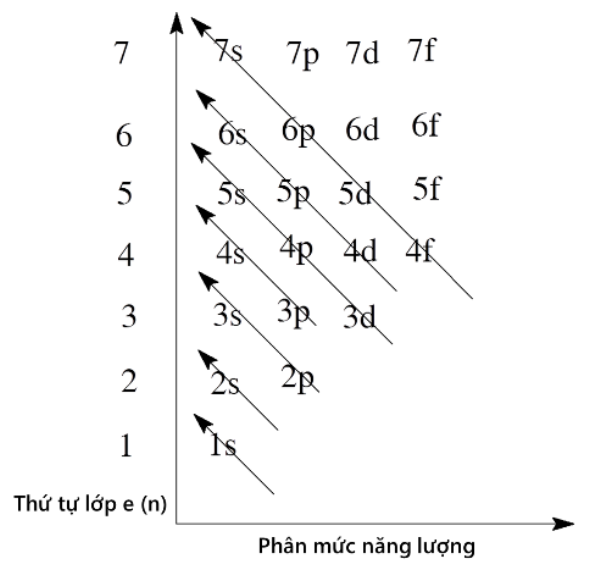

Chính Sách Vận Chuyển Và Đổi Trả Hàng
Miễn phí vận chuyển mọi đơn hàng từ 500K
- Phí ship mặc trong nước 50K
- Thời gian nhận hàng 2-3 ngày trong tuần
- Giao hàng hỏa tốc trong 24h
- Hoàn trả hàng trong 30 ngày nếu không hài lòng
Mô tả sản phẩm
Electron được điền vào các orbital nguyên tử theo nguyên lý Aufbau, nguyên lý Pauli và quy tắc Hund. Nguyên lý Aufbau chỉ ra rằng electron sẽ điền vào orbital có năng lượng thấp nhất trước. Nguyên lý Pauli khẳng định không có hai electron nào trong cùng một nguyên tử có cùng bốn số lượng tử. Quy tắc Hund nêu rằng electron sẽ điền vào các orbital riêng lẻ trong cùng một phân lớp trước khi bắt đầu ghép đôi trong một orbital.
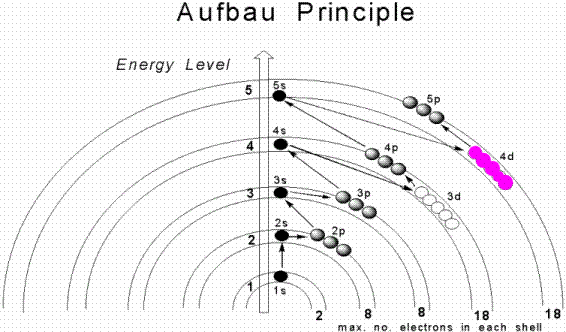
Nguyên lý Aufbau: Điền electron từ năng lượng thấp đến cao
Thứ tự năng lượng của các phân lớp
Thứ tự năng lượng của các phân lớp không phải lúc nào cũng đơn giản là 1s, 2s, 2p, 3s, 3p, 4s... Mà nó phụ thuộc vào điện tích hạt nhân và số electron. Tuy nhiên, một cách tiếp cận gần đúng, dễ hiểu là dựa vào giản đồ năng lượng của nguyên tử. Bạn có thể tham khảo giản đồ năng lượng để hiểu rõ hơn về thứ tự điền electron. Thứ tự năng lượng thường được biểu diễn như sau: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Nguyên lý Pauli: Không có hai electron nào có cùng 4 số lượng tử
4 số lượng tử
Mỗi electron được mô tả bởi bốn số lượng tử: số lượng tử chính (n), số lượng tử momen góc quỹ đạo (l), số lượng tử từ (ml) và số lượng tử spin (ms). Nguyên lý Pauli cho biết không có hai electron nào trong cùng một nguyên tử có thể có cùng bốn số lượng tử. Điều này có nghĩa là mỗi orbital chỉ có thể chứa tối đa hai electron, và hai electron này phải có spin ngược nhau (ms = +1/2 và ms = -1/2).
Quy tắc Hund: Điền electron vào các orbital riêng lẻ trước
Cân bằng năng lượng
Quy tắc Hund nêu rằng khi điền electron vào các orbital trong cùng một phân lớp (ví dụ: 2p), electron sẽ được điền vào các orbital riêng lẻ trước khi bắt đầu ghép đôi trong một orbital. Điều này làm giảm năng lượng của nguyên tử và làm cho nó ổn định hơn.
Xem thêm: số đồng phân thơm của c8h10
Sản phẩm liên quan: tinh bột thuỷ phân
Xem thêm: chất x có công thức phân tử là c 3 h 6 o2 là este của axit axetic công thức cấu tạo thu gọn của x là
Xem thêm: khí màu nâu đỏ là khí gì